
SHP2(Src homology 2 containing protein tyrosine phosphatase2)是由PTPN11基因编码的一种非受体型蛋白酪氨酸磷酸酶(PTP)。SHP2作为磷酸酶,在维持蛋白质酪氨酸磷酸化的稳态过程中起重要的作用,参与调控细胞内多条信号通路(RAS/RAF/MEK/ERK、PI3K/AKT和JAK/STAT)。由于其参与调控多条重要的信号通路,SHP2的过度活化与多种癌症相关。因此,已成为癌症药物研发的重要靶点。
SHP2包含2个SH2结构域(N-SH2, C-SH2),1个高度保守的PTP催化结构域和1个含有2个酪氨酸磷酸化位点(Tyr542和Tyr580)的C端尾部区域。在非活化状态下,SHP2的N-SH2与PTP结构域结合,维持磷酸酶活性的自抑制状态;当SH2与磷酸化的酪氨酸残基结合时,蛋白构象发生改变,自抑制状态解除,发挥磷酸酶的功能使靶点蛋白去磷酸化。
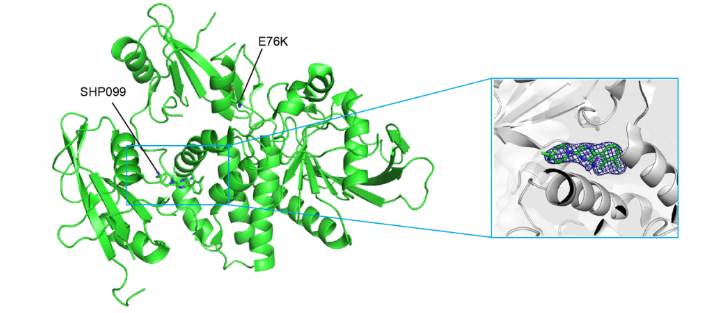
SHP2作为癌症治疗的潜在靶点,其抑制剂的开发已成为抗肿瘤药物研发的热门领域之一。传统的SHP2抑制剂设计思路是针对其正构位点(PTP催化活性中心),然而由于PTP高度保守,导致针对PTP催化结构域设计的小分子抑制剂具有较低的选择性。另一个思路是开发变构抑制剂,诺华在2016年开发的SHP099是针对SHP2靶点的首个变构抑制剂。SHP099与C-SH2,N-SH2和PTP结构域交界处的隧道状变构口袋结合,使SHP2维持在自抑制构象,催化活性受到抑制。

本实验使用的表达系统是大肠杆菌表达系统(BL21),蛋白纯化步骤使用的是Ni-NTA柱纯化,随后过一遍分子筛。

本实验使用坐滴气相扩散法结晶,在同步辐射光源对蛋白晶体进行衍射数据信息收集。

解析SHP099-SHP2复合物的三维结构,分辨率为1.9 Å。
请与我们的服务团队进一步沟通

+86 18962587269(业务咨询-微信同号)
+86 15606230810(求职招聘-微信同号)

江苏省苏州市常熟高新技术产业 开发区贤士路 88 号 6 幢1001
广东省深圳市宝安区西乡街道共乐社区铁仔路52升业空间A栋317

bussiness@readcrystal.com(业务报价)
contact@readcrystal.com(其他合作)
hr@readcrystal.com(求职招聘)


版权所有 © Copyright 2024 苏州青云瑞晶生物科技有限公司 苏ICP备2021032617号 苏公网安备32058102002758号