
亚胺还原酶(IREDs)是依赖NAPDH的酶,可催化亚胺的不对称还原合成手性胺。但IREDs的底物范围很窄,合理的工程设计非常罕见。
2022年,中国科学院微生物研究所高书山团队在国际顶尖学术期刊《Angewandte Chemie》上发表了一篇关于亚胺还原酶IR-G36结构设计的论文。通过合理空腔设计、组合活性位点饱和度测试(CAST)和热稳定性工程相结合,将活性较弱的IR-G36转化为具有优异性能的变体M5,催化效率提高了4193倍。且M5表现出广泛的底物范围,可用于合成不同的氮杂环烷基胺,并且在工业相关条件下以百克规模证明了该反应。
该文章运用了半理性设计手段对酶进行改造。首先在86个IREDs中进行筛选,筛选出具有最佳R选择性(78%)的IR-G36作为下一步进化的目标。接着运用结构生物学的手段,解析IR-G36的空间结构作为酶改造的依据,最终成功改造出催化效率大大提高的变体M5。
本研究中关于IREDs结构解析方面的工作由苏州青云瑞晶科技有限公司提供技术支持。

本研究IR-G36蛋白表达使用的表达系统是大肠杆菌表达系统(BL21),蛋白纯化步骤使用的是Ni-NTA柱纯化,再过一遍凝胶过滤层析。
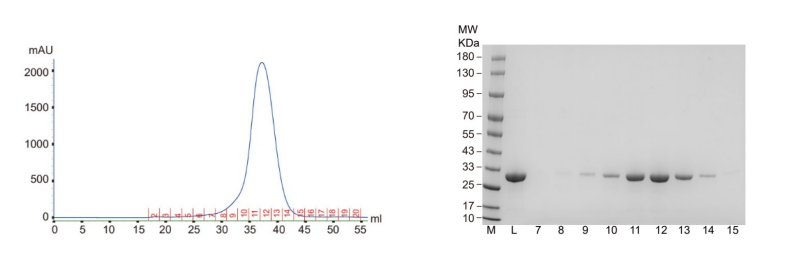
本研究使用坐滴法对IR-G36 WT和IR-G36 M5进行结晶。
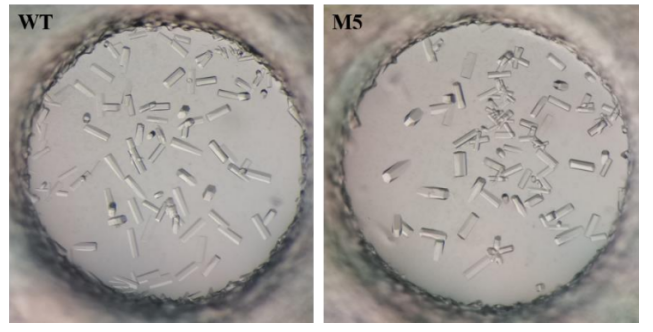
同步辐射光源收集蛋白晶体衍射数据信息。

由于IR-G36与已解析的IREDs同源性<40%,需要从头解析相位。制备重原子(Se原子)晶体衍生物,通过单波长反常色散法(SAD)确定IR-G36 WT的结构。分辨率为2.4 Å。
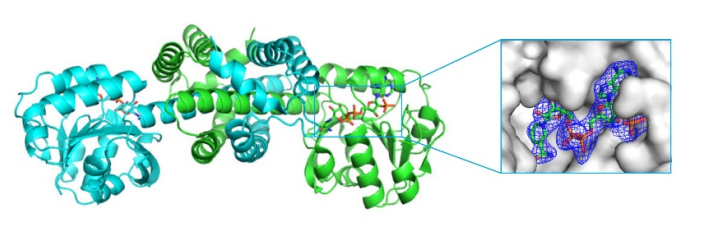
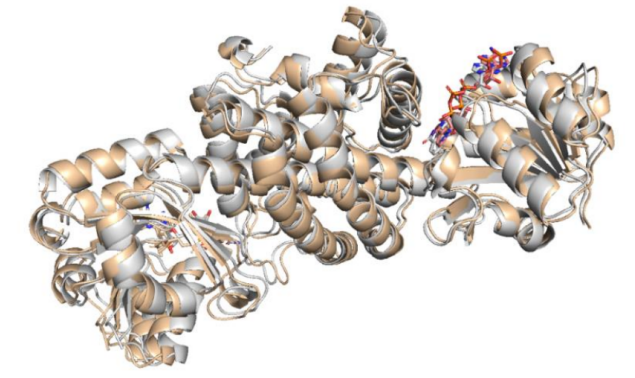
以IR-G36 WT的结构作为模型,利用分子置换法确定IR-G36 M5的结构。
请与我们的服务团队进一步沟通

+86 18962587269(业务咨询-微信同号)
+86 15606230810(求职招聘-微信同号)

江苏省苏州市常熟高新技术产业 开发区贤士路 88 号 6 幢1001
广东省深圳市宝安区西乡街道共乐社区铁仔路52升业空间A栋317

bussiness@readcrystal.com(业务报价)
contact@readcrystal.com(其他合作)
hr@readcrystal.com(求职招聘)


版权所有 © Copyright 2024 苏州青云瑞晶生物科技有限公司 苏ICP备2021032617号 苏公网安备32058102002758号