结构生物学是以分子生物学,生物化学和生物物理学为基础的学科,研究对象为生物大分子,如蛋白质和核酸等。目的是利用生物或物理手段来看清楚生物大分子的精细形态,以阐述生物大分子行驶功能的机制,帮助生物学家更好的认识生命活动的过程。而且,很多药物分子的作用靶点大多为蛋白质,所以结构生物学在药物研发中起到重要指导作用,为机理研究到药物开发带来清晰的认识。
针对生物大分子中的蛋白质的研究,主要的研究手段有:核磁共振(nuclear magnetic resonance,NMR)、X射线晶体学(X-ray crystallography)和冷冻电子显微镜(cryo-electron microscope, cryo-EM)。核磁共振主要针对溶液中的、分子量很小(约20kDa)的样品类型,最近几年已使用不多。近年来,也出现了一些新技术,微晶电子衍射(MicroED)是一种利用冷冻电镜解析微小晶体结构的技术,由于电子束与物质的作用远强于X射线,可以解析X射线晶体学难以处理的纳米晶体结构。特别是对于以往难以培养单晶的蛋白样品来说,MicroED为结构生物学家提供了一个前景广阔的新工具,弥补现有技术的不足。该技术被《Science》杂志评为2018年十大突破技术之一。
早在1895 年,伦琴(W. C. Roentgen)就发现了X射线。X射线的发现推动了现代生物学的发展,甚至可以说对整个科学技术领域产生了极为深刻的影响。1912 年,劳厄(M. V. Laue)与弗里德里希(W. Friedrich)以及伦琴的博士研究生克里平(P. Knipping)利用 X 射线对硫酸铜晶体进行衍射实验,并在底片上得到了一些粗大的、椭圆形的斑点,发现了 X 射线晶体衍射。而后,他们又对 ZnS、 PbS、 NaCl 等晶体进行 X 射线衍射实验,得到了清晰的四重对称衍射图。劳厄还提出了 Laue 方程来描述晶体的 X 射线衍射。ZnS 晶体的 X 射线衍射照片发表不久,布拉格(W. L. Bragg)重复此实验,并在1913年推导出了 X 射线衍射方程,即著名的布拉格方程。X 射线衍射的发现和劳厄方程以及布拉格方程的建立标志着 X 射线晶体学的诞生。到1957年,X射线晶体学就解析得到了第一个生物大分子——抹香鲸肌红蛋白的结构。而到现在为止,约有十五万的生物大分子结构是利用X射线晶体学解析的。X 射线晶体学解析蛋白质三维结构之所以发展如此迅速,主要是因为有以下几点优势:1. 能够达到很高的分辨率,接近原子水平;2. 对蛋白质的大小和成份类型没有限制,所以无论是分子量超大的多亚基复合物还是分子量很小的多肽,都能通过此方法得到理想结果。但此方法必须有高质量的大尺寸晶体作为前提,所以其第二点优势同时是其限制所在,得到质量较好的晶体对于分子量巨大或者结构柔性的对象来说往往较为困难。
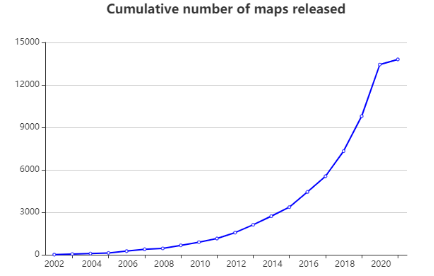
近几十年,冷冻电子显微镜发展迅速,在结构生物学领域逐渐发挥出举足轻重的作用。早在1939年,西门子公司制造了世界上第一台商业化的电子显微镜。为了防止高真空及强烈的电子轰击对样品的破坏,人们用重金属染色或糖包埋的方法处理样品。但由于都对样品进行了破坏性处理且都是在常温条件下进行观察,所以分辨率都受到了限制。到1984年,J. Dubochet等人发展了冷冻生物样品的方法并总结了得到玻璃态冰的方法1,2,这是最早的快速冷冻技术(cryo-freezing) 并开启了“冷冻” 电子显微镜时代。通过将生物大分子的溶液样品快速投入至冷却到液氮温度的液态乙烷中,得到冰层厚度合适的冷冻样品,然后对冰层中均匀分布的生物大分子颗粒进行拍照,得到上千张照片。通过算法对拍到的二维照片进行分析,最终得到其结构,此方法称之为单颗粒分析技术(single particle analysis)。近些年,随着直接电子探测相机(direct detection device, DDD)的出现和各种数据处理软件的发展,冷冻电子显微镜解析的生物大分子三维结构所占比例越来越大(见图1)。比如2020年3月发表在Science杂志的研究通过冷冻电子显微镜单颗粒分析技术,确定了与胰高血糖素及不同类别的异源三聚体G蛋白(Gs或Gi1)结合的人源胰高血糖素受体(GCGR)3.7 Å和3.9 Å的结构(见图2)。该研究的多个结构与药理学数据相结合,为II型糖尿病和肥胖症的治疗提供了重要见解3。
单颗粒分析技术不需要得到晶体且样品使用量非常少,这使得针对难以结晶的膜蛋白或大分子复合物的研究成为可能。然而,虽然单颗粒分析技术对样品要求量较低,却没有降低对样品均一性的高要求。而且,虽然随着探测器和算法的不断提升,单颗粒分析技术已经能够得到分辨率2 Å以内的结构4,但仍然是相对个例,其分辨率普遍还是在3 Å左右。不过,人类之所以能创造文明,就在于对神秘自然、科学真相永无止境的探索;而各研究领域的不断发展推进,势必会相互影响、相互促进。
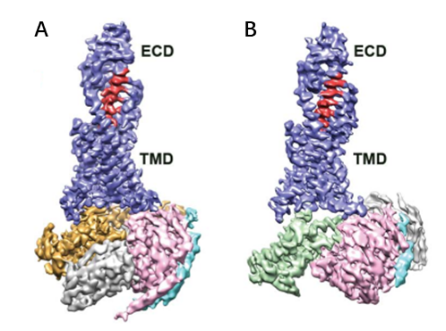
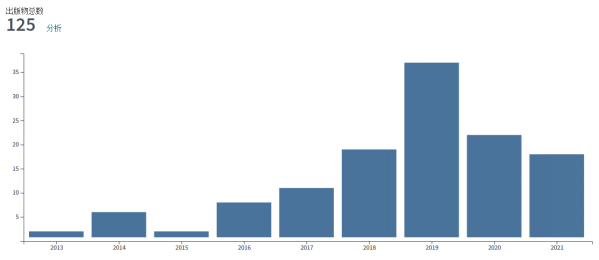
在电子显微镜发展初期,X射线晶体学技术正蓬勃发展;此时,也正处于衍射理论和数据处理方法逐渐成熟之时。电子晶体学就是电子显微镜技术与晶体学结合的产物。在2007年,斯德哥尔摩大学的科学家聪明地将晶体学和电镜相结合,用冷冻电镜去看晶体,发展出了一项重要的新技术——MicroED (Micro electron diffraction)。MicroED主要是通过电子对微小的晶体进行衍射,然后收集电子衍射数据并进行蛋白质结构解析的方法。由于电子的波长短,则受物质散射强(原子对电子的散射能比 X 射线强一万倍),所以能够达到的分辨率更高。而且其需要的晶体尺寸非常小,亚微米尺寸的晶体就可以产生足够高的信噪比衍射信号。这些独特优势对于那些能够得到微小晶体而尺寸无法优化变大的样品来说,无疑是个好消息。这种技术2018年还被《Science》杂志评为2018年十大技术突破之一。在 MicroED 发展初期,溶菌酶、catalase和 Ca2+-ATPase等模式样品就被解析到原子分辨率。后来MicroED 进一步发展,不再局限于模式样品,还解析了α-synuclein中心肽段和R2lox酶6等未知蛋白的结构(见图3),并且分辨率都高达~1 Å。2016年后,MicroED发展迅速,解析的蛋白质结构的数量也快速增加(见图4),prions和 FUS LC(fused in sarcoma low-complexity domain)等样品的晶体结构都得到了1 Å左右的高分辨率(见图4)。而后MicroED解析的对象难度逐渐增加,甚至还包括了复合物和离子通道等膜蛋白(见图4)。从2018年开始,人们将MicroED与冷冻聚焦离子束技术(cryo-Focused Ion Beam, cryo-FIB)技术相结合,可以将尺寸稍大但仍不适用与X射线晶体学的晶体剪薄,将适用于MicroED的晶体尺寸范围扩大至几十微米,大大拓宽了MicroED技术的应用范围,填补了MicroED和X射线晶体学之间的空隙。
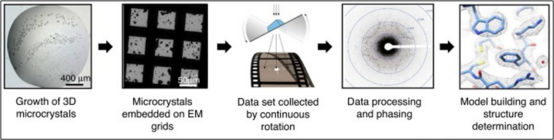
MicroED的原理类似于X射线晶体学。电子波同X射线一样,照射到类似晶体的样品上时也能够发生衍射现象。当中间镜的物平面位于物镜的后焦面时,将在荧光屏上得到经中间镜和投影镜放大了的电子衍射谱,即为透射电子显微镜的衍射模式。在实际的透射电子显微镜中,成像模式和衍射模式的中间镜电流已设置好,通过相应按钮(Diffraction按钮)即可实现两个模式的切换。MicroED对结构生物学领域起到了很好的补充。
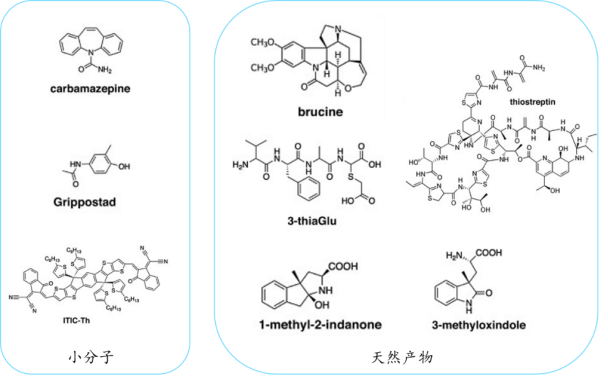
由于MicroED的独特优势,除了生物大分子之外,其对化学小分子、天然产物、药物制剂的研究更是再合适不过了。因为化学小分子呈现粉末状,尺寸上与MicroED的研究范围非常契合,而且基本可以在几个小时内从粉末得到其结构信息。很多利用MicroED研究化学小分子的成功案例都验证了此技术的高效性和应用性(见图6)。MicroED在生物大分子和小分子药物上的研究展示了其在结构生物学领域的巨大应用潜力,为结构生物学家提供了一个前景广阔的新工具。
总体说来,无论是X射线晶体学与冷冻电镜单颗粒技术,还是新兴的MicroED技术,都是科学家在不断尝试与优化中逐步推进的。它们在技术和研究范围上相互补充,互相促进,尽最大可能让人类无穷接近自然真相,继续引领生命科学的发展。对于商业化的结构生物学测试服务,据了解,青云瑞晶公司自拥有MicroED国际先进的测试平台,同时提供SCXRD和CryoEM-SPA的测试服务。
参考文献
1 Dubochet, J., Adrian, M., Lepault, J. & McDowall, A. W. Emerging techniques: Cryo-electron microscopy of vitrified biological specimens. Trends in Biochemical Sciences 10, 143-146 (1985).
2 Adrian, M., Dubochet, J., Lepault, J. & McDowall, A. W. Cryo-electron microscopy of viruses. Nature 308, 32-36 (1984).
3 Qiao, A. & Han, S. Structural basis of G(s) and G(i) recognition by the human glucagon receptor. 367, 1346-1352 (2020).
4 Yip, K. M. F., N. Atomic-resolution protein structure determination by cryo-EM. 587, 157-161 (2020).
5 Shi, D., Nannenga, B. L., Iadanza, M. G. & Gonen, T. Three-dimensional electron crystallography of protein microcrystals. Elife 2, e01345 (2013).
6 Xu, H. et al. Solving a new R2lox protein structure by microcrystal electron diffraction. Science Advances 5 (2019).
7 Nguyen, C. & Gonen, T. Beyond protein structure determination with MicroED. Current Opinion in Structural Biology 64, 51-58 (2020).