Structure Based Drug Design (SBDD),中文译作基于结构的药物设计。随着对药物靶标蛋白三维结构的认识,和靶标蛋白与先导化合物或者天然配体间相互作用位点的了解不断加深,一种基于靶标-配体相互作用的分子设计策略崭露头角。蛋白表达、纯化和蛋白晶体学的快速发展为与疾病相关蛋白靶标提供了详细的结构信息。同时化学合成的发展也很及时,新型的有效试剂、保护基、催化转移以及多步合成策略为基于结构的药物设计提供了巨大创新潜能。基于结构进行药物设计这一手段,革命性地改变了药物化学的研究策略,同时也改变了新药筛选和优化的方法。
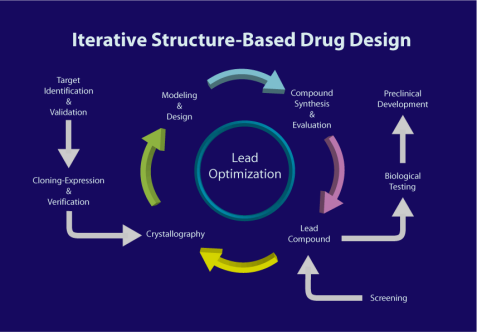
罗氏公司曾利用SBDD的方法开发了一款蛋白酶抑制剂Saquinavir,这款药物使HIV-AIDS 的治疗成为可能,也展现了这种设计方法巨大的潜力。随后,治疗高血压、HIV/AIDS、各种癌症和其他人类疾病大量新药研发成功。近期,SBDD又应用于开发治疗新冠病毒的药物研究中。
基于结构的设计策略,需要先得到靶标蛋白结合位点的形状和电荷特征信息,还要测定并解析蛋白质-配体复合物的晶体结构,从而获得二者相互作用的信息。这种分子水平的结构解析常常能为分子设计提供配体的活性构象。这些关键的信息,使得基于结构的设计策略可以在保持先导化合物框架的同时,进行结构优化,从而提高药物的活性和选择性。而在这一过程之中,将会运用到一个十分重要而基础的学科——大分子晶体学。
下文,我们将会详细介绍大分子晶体学是如何参与到SBDD的每一个阶段,并如何对创新药研发起到指导性意义。
1.蛋白质功能预测
现代新药研究与开发至关重要的第一步是寻找、确定和制备药物筛选靶标—分子药靶。数据分析统计显示,当前市场现有的药物中,以蛋白受体为作用靶点的药物超过50%,足以体现蛋白质在药物作用靶点中的重要地位。
蛋白质的功能主要通过实验手段来验证,如果实验无法提供所需信息,还可以通过蛋白的序列相似性进行推断。但是仍有大量的蛋白序列与当下已知功能的蛋白没有任何密切相关的相似性,这时就需要通过对蛋白质结构的预测和分析来得到功能相关的线索。
从结构预测蛋白质功能主要依赖以下几个途径:
1)Folding match
功能相似的蛋白通常也拥有相似的折叠方式,通过比对和匹配分析找到结构上具有相似折叠走向的蛋白是基于结构的功能预测的第一步。
2)Surface clefts and binding pockets
蛋白质表面的clefts(管道状、凹槽状、浅洼状区域)和pockets(口袋状区域)也是推测其功能的重要线索,许多与蛋白相互作用的其他蛋白、底物和调控元件通常会更有可能结合在clefts和pockets区域。比如在一些酶的表面找到两个最大的clefts,通常情况下,这之中的一个会是它们的活性位点或者催化位点。
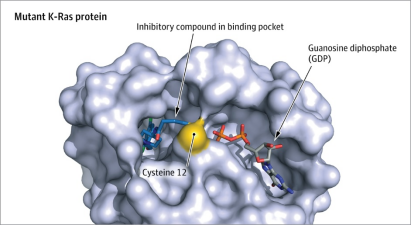
3)Residue template methods
具有某种特定功能的蛋白质往往都能找到其受三维结构中某一个小范围区域的少量残基影响的证据。酶的催化功能会由位于活性位点的少量催化残基来执行;DNA结合蛋白表面的几个特定残基,就决定了它能与某段DNA序列特异性结合,或者通过自己结构基序(Motif)中的一部分来结合DNA,例如最常见的HTH基序。残基的特定排列和构象对蛋白行使功能至关重要,且在进化过程中高度保守,变化很小。
4)Phylogenetic relationships
由于蛋白质结构中决定功能的重要区域在进化过程中极有可能高度保守,因此可以通过系统发育分析或tree-determinant residues 来推测和评定蛋白的功能。
5)Machine learning techniques
除了依照现有的结构相似性来推测蛋白质的功能,我们还可以通过计算机方法,例如统计方法、数据挖掘方法和机器学习技术(支持向量机和神经网络),来尝试预测催化残基、蛋白质-蛋白质结合位点和酶家族分类。
2.成药性评价
想要获得一个有作用效果的、有选择性的,且有口服活性的药物分子,其蛋白靶点上必须存在有合适的结合口袋。结合口袋分为两类,一类允许药物到达作用位点,另一类在药物到达作用位点之后,介导其与分子靶点之间的相互作用。
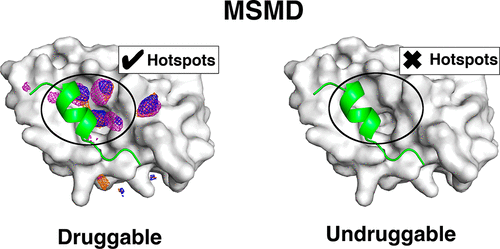
可成药靶点的通用判断标准为:具有大小合适的结合位置(一般可容纳分子量达到500Da的化合物)、适当的亲脂性和足够氢键成键位点。这些特性都可以从蛋白晶体结构中判断出来。
此外,如果蛋白中存在变构结合位点和不同的结构构象,也可以大大增加药物结合的概率。 基于结构评估药物的靶向性,主要是预测蛋白质上是否存在与药物性质互补的配体结合位点。自动识别配体结合位点主要使用两种方式:
第一是单独使用几何因素。通过观测2D或3D的蛋白质构象来辨别其上是否有合适的结合口袋。蛋白质从空间结构上可以分为3个区域:一是核心主体区域,由蛋白自身原子构成的内部致密区域;二是溶剂接触界面,蛋白质与承载它的溶剂所接触的外表面区域;三是腔体区域,腔体区域一般隶属于溶剂接触界面的一部分,但该部分深入蛋白质主体区域内部形成一个凹陷空间,药物结合口袋一般就在蛋白的腔体区域内。
除此之外,还可以结合蛋白质腔体表面的特定物理化学性质进行判断。可成药的蛋白靶点应当与药物样分子本身具有镜像的物理化学性质。因此,蛋白口袋的大小和形状特征,疏水性的测量(即氢键供体与受体的相对数量,以及蛋白腔体内极性与疏水原子的相对比例),是识别药物结合口袋时重要的评价指标 。
基于结构评估靶点成药性的方法通常有三种:第一,通过结构算法预测并评估潜在的药物结合位点;第二,基于蛋白的结合口袋的理化性质使用特定的判别函数;第三,根据已知结果(成药难度)标记的靶点参考集合来对一个大型化合物库进行比对和筛选。