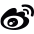大肠杆菌表达系统具有遗传背景清楚,目的基因表达水平高,培养周期短,成本低等特点, 是分子生物学研究和生物技术产业化发展进程中的重要工具。我们通过大肠杆菌表达系统合成目的蛋白时会碰到的一个问题是,如何去除大肠杆菌本身的蛋白(内源性蛋白),特别是在目的蛋白表达量比较低的情况下。本文主要介绍如何在利用大肠杆菌表达纯化蛋白的过程中去除内源性蛋白,进而达到提高目标蛋白纯度的目的。
目前,蛋白纯化最常用的方法是亲和层析和离子交换层析。亲和层析是基于生物高分子与配基可逆结合的原理,使配基通过共价键牢固结合于载体上而制得的层析系统。主要有:Ni柱亲和层析、GST亲和层析、Protein A亲和层析、FLAG-tag亲和层析、Strep-tag层析和 MBP-tag(麦芽糖结合蛋白)层析等。其中最常用的是Ni柱亲和层析和GST亲和层析。它们的操作过程大体相似,都是先平衡再上样,之后洗杂,最终洗脱目的蛋白(如图1)。
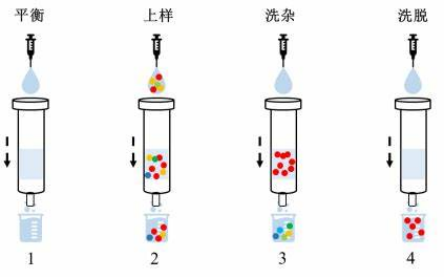
大肠杆菌常见的内源性污染蛋白有三类。第一类:Fur, Crp, SlyD, ArgE, Cu/Zn-SODM 和YodA,Ni柱纯化洗脱的咪唑浓度大于80mM;第二类:GlmS, ODO2, YadF, CAT, GlgA, Yf bG 和 G6-PD,Ni柱纯化洗脱的咪唑浓度55 和 80 mM 之间;第三类:Hsp60 和ODO1,Ni柱纯化洗脱的咪唑浓度30 和 55 mM。这三类蛋白的性质见表1。Ni柱纯化蛋白常见的污染蛋白是70KDa左右的内源性蛋白(YfbG和GlmS),和25KDa左右的内源性蛋白(SlyD,Crp和YodA等)。如果目的蛋白的含量比较低,70KDa和25KDa的内源性蛋白污染就比较难通过Ni纯化去除。
下面介绍本公司一个Ni柱纯化蛋白的案例。
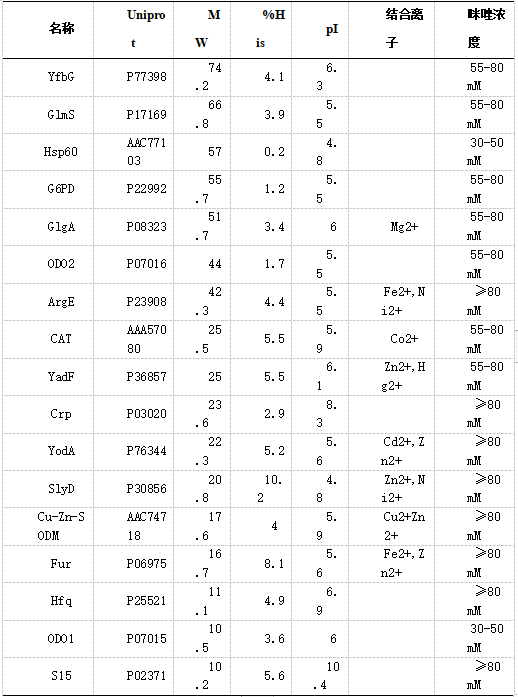
案例一,该蛋白带有6个His标签,分子量为66.3kDa,pI为7.99。使用Ni柱纯化,将Ni柱洗脱出的各组分进行SDS-PAGE验证。具体结果如图2所示:
通过L和FT对比可以看出,蛋白在上样之后,杂蛋白非常多,其中也包含一些内源性蛋白,但这些内源性蛋白与目的蛋白没有相互作用或相互作用很弱,因此可以先用低浓度的咪唑来清洗。将20i和250i对比可以看出,清洗之后仍有部分蛋白停留在Ni柱上无法与目的蛋白分开,可知这些内源性蛋白与目的蛋白相互作用较强或者与Ni柱的结合比较强,需要使用分离效果更强的离子柱将它们分离。
离子交换层析是通过带电的溶质分子与介质中可交换的离子进行交换,从而达到分离纯化蛋白的目的(如图3)。离子交换层析又可分为阴离子层析或阳离子层析,如果目的蛋白的等电点(pI)已知,可选择阴离子层析且操作的pH要高于目的蛋白的pI,或选择阳离子层析且操作的pH低于目的蛋白的pI。
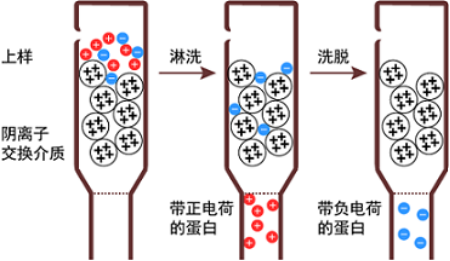
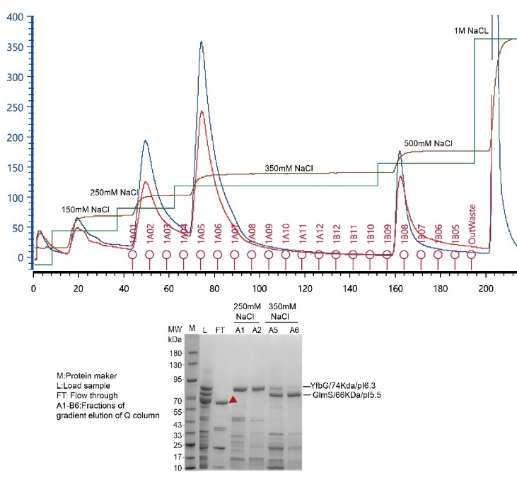
与Ni柱纯化不同的是,离子柱需要低盐上样,高盐洗脱。将蛋白的盐浓度稀释至50mM左右,再上柱。采用AKTA进行梯度洗脱时,每次增加100mM的盐浓度,直至将蛋白全部洗脱下来。最后进行SDS-PAGE蛋白电泳来查看目标蛋白的具体出峰位置。在上述案例中,目的蛋白pI为7.99,这个pI值不太好选择离子柱,因为蛋白纯化用缓冲液一般选择pH值7-8的缓冲液体系。因此, 分子量70KDa大小的内源性杂蛋(YfbG和GlmS,等电点分别为6.3和5.5),在配制buffer时可以将pH校准至8.0左右, 在此pH值下YfbG和GlmS带负电,可以结合到阴离子柱Q柱上,目的蛋白则流穿。
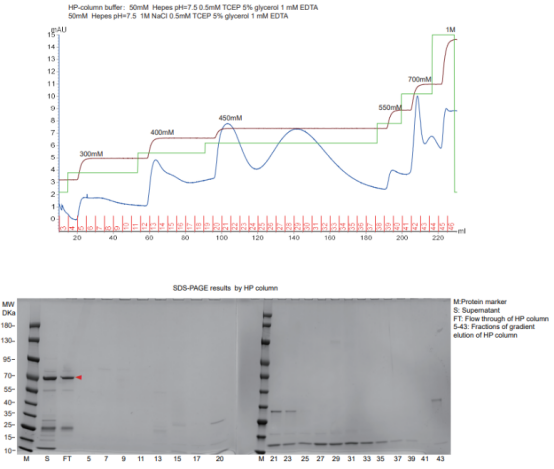
案例二、Heparin阳离子柱在纯化大肠杆菌蛋白时对一些内源性蛋白也有较好的分离效果,以我们公司的一个蛋白纯化结果为例(如图5):
此案例中目的蛋白的pI为8.2,但buffer的pH为7.5,因此蛋白无法挂柱。通过图5中的supernatant和flow through可以确认目的蛋白全部流穿。再将supernatant和flow through相比,10-15kDa和25-35kDa两处杂蛋白全部挂柱。Heparin阳离子柱通常能够把这两处杂蛋白全部吸附住,如果目标蛋白pI偏高就可以配制pH低于目标蛋白pI的buffer,使其流穿,有效去除10-15kDa和25-35kDa这两处的杂蛋白。
在纯化蛋白的过程中选择正确的纯化方法能够达到良好的纯化效果并降低蛋白纯化难度,提前查阅了解蛋白的信息和性质十分重要,在对纯化蛋白有了充分的了解之后就能制定出合适的纯化方案,最终获取高纯度的蛋白。