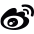近年来,获得有效的天然产物已经越来越难,药企又不能将创新药研发寄望于“偶然发现”。研发思路需要从“偶然发现”到“合理设计”转变,才能真正摆脱新药研发投资高、周期长、风险大的固有印象。目前“合理药物设计”几乎成为了各大制药公司和Biotech对于创新药物开发的常规思路和方法。
合理药物设计(Rational Drug Design),是基于结构的药物设计,通过对药物结构和体内靶点相互作用的研究,使药物达到需要的目的,如抑制酶的活性、促进某种物质的释放、阻碍通道等。这过程很大程度上依赖于对靶点和药物三维结构的理解,因此,结构生物学对药物研究产生了深远的影响。对于小分子药物的设计,靶标蛋白-小分子配体的共晶结构(以下简称为“共晶结构”)是药物设计过程中最关键的信息。
共晶结构信息不仅能揭示两者的结合模式和生物活性构象、发现新的结合口袋或变构结合位点,而且丰富了合理药物设计途径,如基于结构的药物设计(SBDD)、基于片段的药物设计(FBDD)、计算机药物辅助设计(CADD)、AI药物发现等。
一直以来,结构生物学研究中获得蛋白三维结构信息主要是通过X射线晶体学和核磁共振NMR的方法。其中,NMR只能针对溶液中的、分子量很小(约20kDa)的样品进行测试,最近几年已使用不多。因此,PCB中绝大多数的结构是通过X射线晶体学来获取(图1 PCB数据统计结果)。

近二十多年来,基于冷冻透射电子显微镜开发的单颗粒技术(CryoEM-SPA)有了显著的进步,其无需进行结晶即可对蛋白样品进行结构解析。但cryoEM-SPA相对低的分辨率(一般>3Å),一般更适用于大分子量的蛋白(>200KD),而且设备成本昂贵等,也限制了SPA进一步的发展。
目前,最新的结构生物学结构解析技术是基于冷冻透射电镜开发的另一种技术——微晶电子衍射MicroED。其利用电子束可以对微小晶体样品进行测试,通过对衍射图谱进行分析,完成结构解析。MicroED有能力达到与X射线晶体学几乎一样的高分辨率,而且测试需要的单晶样品仅需要百纳米级别大小,大大降低了蛋白单晶培养的难度和周期。鉴于其将在药物研发领域发挥极大的作用,Science杂志评选MicroED为2018年十大技术突破之一。

本文重点介绍MicroED的技术特点,并与传统X射线晶体学对比,并且列举案例说明MicroED是如何帮助药物设计中的研究人员快速得到关键的共晶结构信息。
自1912年劳厄发现X射线晶体衍射现象,小布拉格开创X射线晶体学以来,已经过去了100年。这一发现,对人类科学的发展,特别是微观结构科学的影响至为巨大,具有里程碑的意义。在这100年中,X射线晶体学发展迅速,成果累累。X射线晶体学包括晶体生长,衍射数据收集及处理和结构解析三个步骤,其中晶体生长是最大的瓶颈,在这个步骤中,需要将蛋白质颗粒在溶液中培养成为尺寸足够大的晶体(约200微米以上尺寸)。即使在大科学装置同步辐射中,利用高强度的X射线对样品进行测试,也是需要样品培养成50微米尺寸以上。众所周知,对于许多蛋白来说,常常难以得到这种尺寸的晶体。
MicroED利用冷冻电镜的设备,通过将高能电子轰击纳米晶体产生衍射数据,进行结构解析。MicroED是衍射技术的一种,由于晶体与高能电子的相互作用远远强于与X射线的相互作用,因此,与X射线晶体学相比,MicroED结构解析所需的晶体尺寸大大降低,仅需100纳米大小的晶体即可进行测试。
对于药物研发中重要的共晶结构解析,MicroED所需的晶体尺寸大幅度降低,能够带来应用层面的诸多优势:
1. 提高难结晶样品结构解析的成功率
2. 显著提高获得共晶结构的成功率
3. 提高研发迭代效率
4. 降低蛋白消耗量
以下分别具体举例说明MicroED的技术优势。
案例一:HIV-1蛋白酶
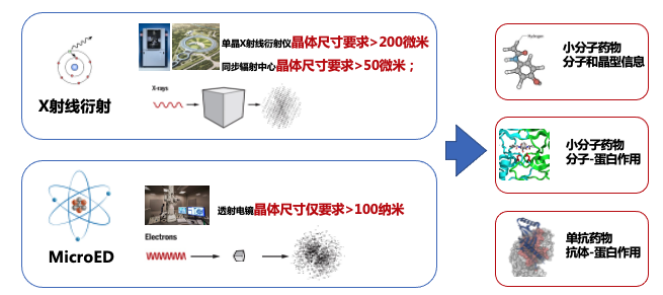
在HIV病毒成熟期间,HIV-1蛋白酶会切割Gag蛋白,从而组装出成熟的HIV病毒。因此,潜在的治疗策略是阻断Gag与HIV-1蛋白酶的相互作用。小分子抑制剂bevirimat就是设计用来抑制HIV-1蛋白酶的的活性的,但由于足够尺寸的晶体样品获取困难,用X射线晶体学的方法不能解析HIV-1-Gag-bevirimat的共晶结构。最终通过MicroED解析了HIV-1-Gag-bevirimat共晶的结构。该结构揭示了bevirimat和蛋白之间的静电和疏水相互作用,为基于结构的药物设计和开发出更有效的抑制剂供了基础。
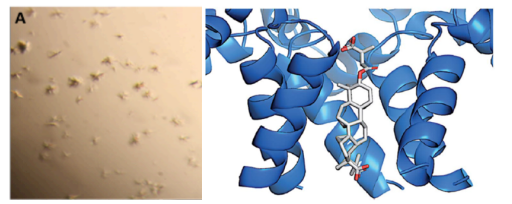
案例二:MicroED解析膜蛋白结构
膜蛋白的结构解析一直是困扰学术界的难题,Lipidic cubic phases (LCP)技术能够帮助膜蛋白进行结晶,因此极大的促进了膜蛋白晶体学的发展。但用LCP技术长膜蛋白晶体往往长出的是微晶,晶体尺寸达不到XRD收集的要求,却十分适合MicroED技术。下图便是MicroED技术解析的GPCR蛋白A2AR。A2AR是一种重要的潜在药物靶标,研究表明,其与肿瘤、帕金森病、药物成瘾和精神疾病等有重要关系。
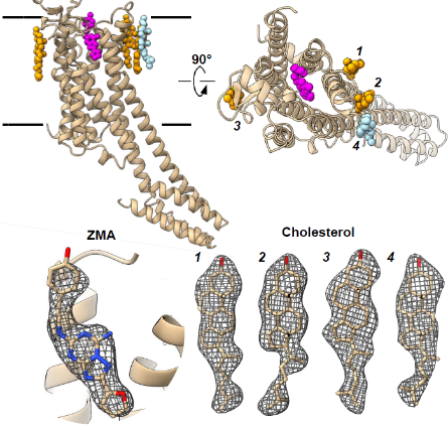
案例三:MicroED测定多肽的结构
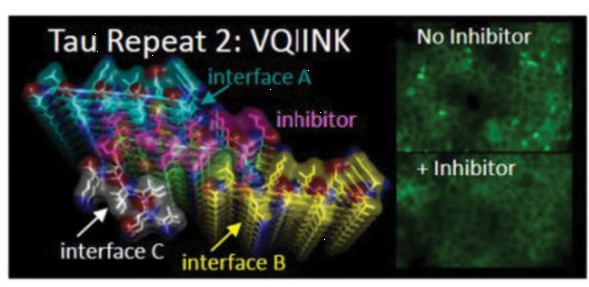
多肽具有重要的生物学功能,解析多肽的结构对于理解多肽的生理机制具有重要的作用。但是有的多肽的结构用X射线晶体学并不能解析。例如,tau蛋白聚合与多种神经系统疾病有关(包括阿尔茨海默氏病)。tau蛋白的VQIINK区段驱动大脑淀粉样蛋白纤丝的聚集和形成,因此对该区段的抑制可能可以阻止疾病的进展。研究人员试图长出这个区段的大晶体,但是都只能拿到微晶,因此不能通过X射线的方法解析这一区段的晶体结构。最终,采用MicroED技术解析了KVQIINKKLD区段1.1 Å分辨率结构。基于解析的结构,研究人员设计了一系列的抑制剂并且找到了具有很好抑制效果的抑制剂,如下图所示。
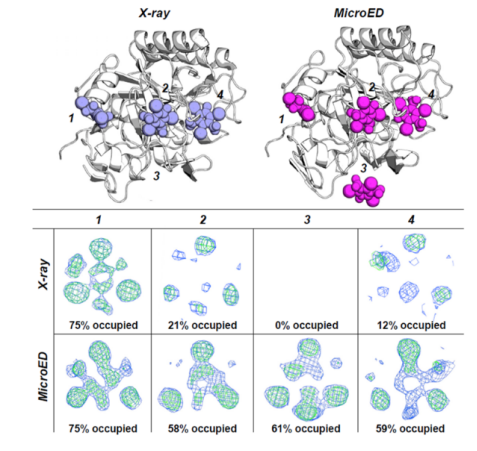
对于小分子共晶到蛋白中来常用的办法是通过浸泡Soaking来实现。由于通过X射线晶体学来进行结构解析,需要蛋白晶体的尺寸足够大,小分子浸泡的过程中往往导致大尺寸的蛋白单晶造成碎裂,最终晶体质量下降而不能得到共晶结构。MicroED只需要100纳米的蛋白晶体,小分子浸泡后破碎的几率大大降低,并且提高小分子的空间占有率。因此,MicroED能够显著提高浸泡成功率和共晶结构解析的成功率。
研究人员以往蛋白酶K的4个结合口袋浸泡I3C小分子为例比较了MicroED和X-ray射线晶体学在获得蛋白质小分子共晶方面的差异。结果表明,由于MicroED采用的是纳米级微晶,小分子扩散到蛋白口袋中的效率非常高效,4个结合口袋中小分子的占有率都比X射线解析的结构好,如下图所示。因此,通过MicroED的方法,在微小晶体中浸泡小分子的效果明显好于X射线晶体学所要求的大尺寸晶体。这将极大的加快FBDD、CADD和AI药物研发进程。
(1)XRD需要尺寸大的完美晶体。很多时候,难以得到大晶体,或者得到大尺寸晶体但其中缺陷很多,需要多轮的尝试优化,才能提高晶体质量。而MicroED所需纳米晶体,易于获取,并往往缺陷更少,质量更高,因此无需大量优化的时间。
(2)实验室MicroED设备 vs. 稀缺同步辐射的机时。MicroED设备能够在实验室部署,在拿到样品后,最快当天进行测试。而同步辐射装置属于国家大型基础科学设备,数周或者数月才能有一次机时。因此,常常是制备好待测试的样品后,但是需要等很长时间的机时。
用传统XRD进行蛋白结构解析时,需要进行少则数百次,多则数千次结晶筛选,因此蛋白消耗量很大。对于一些表达量低的蛋白,蛋白生产成本不可忽视。而在利用MicroED在进行结构生物学研究时,由于晶体尺寸要求低、完美度要求低、浸泡成功率高的优势,所需要进行结晶筛选的次数显著减少,因此也降低重组蛋白的消耗量。
MicroED技术对于生命科学和药物发现领域所主要关注的蛋白-小分子配体复合物共晶结构的解析具有独特的优势。
MicroED技术对于生命科学和药物发现领域所主要关注的蛋白-小分子配体复合物共晶结构的解析具有独特的优势。
基于自主研发的MicroED相关的技术、软件和算法,青云瑞晶提供国际顶尖的商业化MicroED结构生物学服务。同时,青云瑞晶也提供基于同步辐射XRD和CryoEM-SPA冷冻电镜单颗粒的结构生物学服务。
参考文献:
[1]. PURDY M D, SHI D, CHRUSTOWICZ J, et al. MicroED structures of HIV-1 Gag CTD-SP1 reveal binding interactions with the maturation inhibitor bevirimat [J]. Proc Natl Acad Sci U S A, 2018, 115(52): 13258-63.
[2]. MICHAEL W. MARTYNOWYCZ A S, ET AL. MicroED structure of the human adenosine receptor 2 determined from a single nanocrystal in LCP [J]. biorix, 2020,
[3]. SEIDLER P M, BOYER D R, RODRIGUEZ J A, et al. Structure-based inhibitors of tau aggregation [J]. Nature chemistry, 2018, 10(2): 170-6.
[4]. MARTYNOWYCZ M W, GONEN T. Ligand Incorporation into Protein Microcrystals for MicroED by On-Grid Soaking [J]. Structure, 2021, 29(1): 88-95 e2.