微管蛋白由两种类型的微管蛋白亚基,即α-tubulin蛋白和β-tubulin蛋白组成。微管蛋白在有丝分裂、细胞信号转导和细胞器运输等多种细胞功能中发挥着重要作用,是肿瘤治疗的重要靶点。
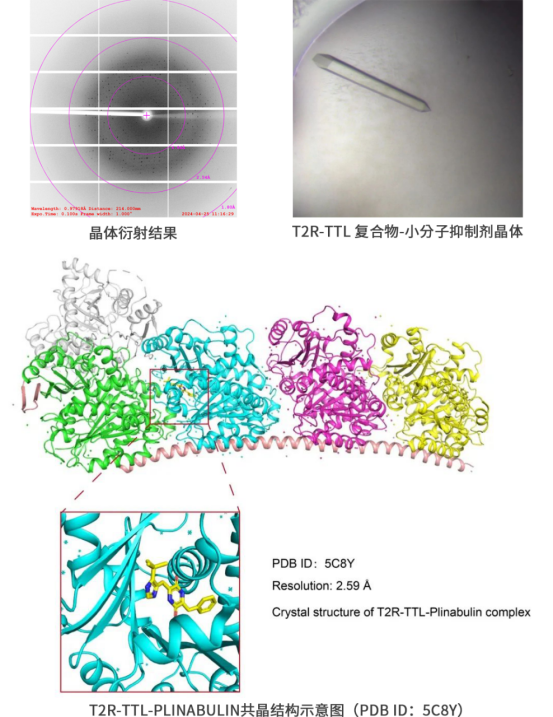
青云瑞晶已完成T2R-TTL复合物(包括2 α-tubulin,2 β-tubulin,RB3和TTL)相关蛋白的表达纯化,复合物组装和复合物结构解析工作。成功重复出T2R-TTL复合物和Plinabulin晶体,并解析了该复合物结构(PDB ID:5C8Y)。在该系列蛋白的表达以及与抑制剂的共晶结构解析方面累积了丰富的实验经验,已记录实验条件100+。基于这些实验条件和库存蛋白,青云瑞晶将项目的交付时间缩短至1-2个月,并确保项目的成功交付。
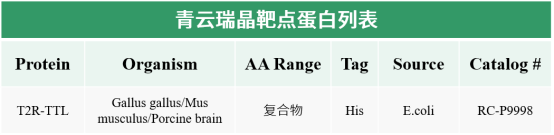

α/β-Tubulin二聚体的表达纯化难度极大,且在蛋白浓度过高时,二聚体容易倾向于聚集状态,因此难以获取单独的Tubulin和小分子的复合物晶体。而使用冷冻电镜方法解析的α/β-Tubulin二聚体多为高聚物,分辨率极低,不适用于研究有小分子结合时的复合物状态。因此,在使用晶体学手段解析Tubulin和小分子的复合物结构时,通常选择由瑞士Paul Schurrer研究所(PSI)发展的T2R-TTL复合物结晶体系,该体系十分成熟,已经用于数十种个不同结构的MTA-微管蛋白复合物结构解析。
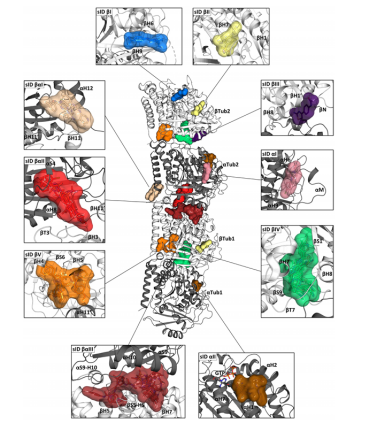
蛋白纯化结果(周期:现货/定制3周)
结晶和结构解析(周期:1-2周)
01.微管蛋白组装过程
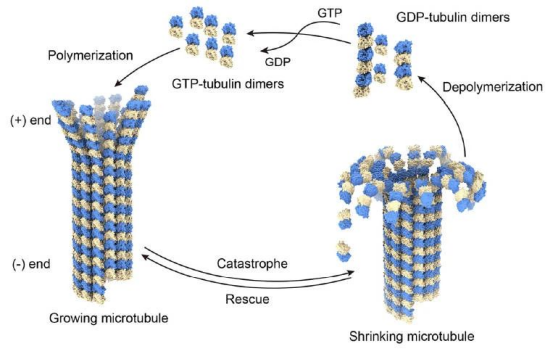
微管是由α-和β-亚型微管蛋白聚合成原丝再进一步聚合而成的中空管状物,是细胞骨架的主要成分,并参与有丝分裂、细胞迁移、胞内转运、信号转导等多种生物学功能。大分子的结构研究对理解其生物学功能和药物作用机制具有非常重要的价值。
微管主要装配方式是:首先,α-微管蛋白和β-微管蛋白形成长度为8nm的αβ二聚体,αβ二聚体先形成环状核心(ring),经过侧面增加二聚体而扩展为螺旋带,αβ二聚体平行于长轴重复排列形成原纤维(protofilament)。
当螺旋带加宽至13根原纤维时,即合拢形成一段微管。新的二聚体再不断加到这一端微管的端点使之延长。最终微管蛋白与微管达到平衡。原纤维中重复的亚单位是αβ异二聚体,αβ→αβ→αβ,微管中这种亚单位排列即构成微管的极性,所有的微管都有确定的极性。微管的两个末端在结构上不是等同的,这是非常重要的结构特征。细胞内所有由微管构成的亚细胞结构也是有极性的。αβ→αβ即为头→尾的方向,微管蛋白加上或释放主要发生于(+)极,微管的延长主要依靠在(+)极组装GTP-微管蛋白,然后GTP水解为GDP或GTP与微管蛋白分离。
目前的微管装配动态模型认为,微管两端具GTP帽(取决于微管蛋白浓度),微管将继续组装,反之,具GDP帽则解聚。在一定条件下,微管一端发生装配使微管延长,而另一端发生去装配而使微管缩短,称为踏车现象。
02.靶向药物
靶向微管的药物(Microtubule-targeting agents ,MTAs)可分为微管稳定剂(MSAs)和微管失稳剂(MDAs)。微管蛋白上有6个MTA结合位点,其中5个位于β-微管蛋白。pironetin位点是目前已知的唯一位于α-微管蛋白。与紫杉烷和月桂酰胺位点结合的MTA属于MSA,与长春花碱、秋水仙碱、美坦星和吡咯烷酮位点结合的MTA属于MDA。微管在细胞分裂中具有极其重要的作用, 破坏有丝分裂纺锤体的形成会影响所有分裂细胞。对于增殖速度比多数正常细胞快的癌细胞,抗有丝分裂的药物用于抗肿瘤治疗时可以优先杀死癌细胞,使得微管蛋白作为肿瘤方向药物研发的重要靶点。
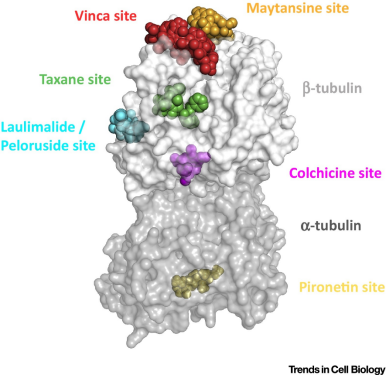
由于微管在细胞有丝分裂过程中承担的重要作用,微管蛋白逐渐成为医药工作者研究与开发抗癌药物的重要靶点之一,而以微管蛋白为靶点的微管蛋白抑制剂也已成为临床证实有效的抗肿瘤药物。该类抑制剂的作用机制是在快速分裂的肿瘤细胞中,通过抑制微管蛋白的聚合或者促进微管蛋白的聚合而干扰细胞的有丝分裂过程,使细胞有丝分裂中断,停滞于M期,从而导致肿瘤细胞发生凋亡,发挥抗肿瘤作用。根据作用机制的不同,微管蛋白抑制剂可分为两大类:
①抑制微管蛋白聚合的微管蛋白解聚剂,如秋水仙碱类和长春碱类化合物;
②促进微管蛋白聚合的微管蛋白聚合剂,如紫杉醇及其类似物,埃博霉素及其类似物。
根据微管蛋白抑制剂在微管蛋白上的作用位点的不同,微管蛋白抑制剂又可分为3种类型:
①作用于秋水仙碱位点的微管蛋白抑制剂;
②作用于长春碱位点的微管蛋白抑制剂;
③作用于紫杉醇位点的微管蛋白抑制剂。
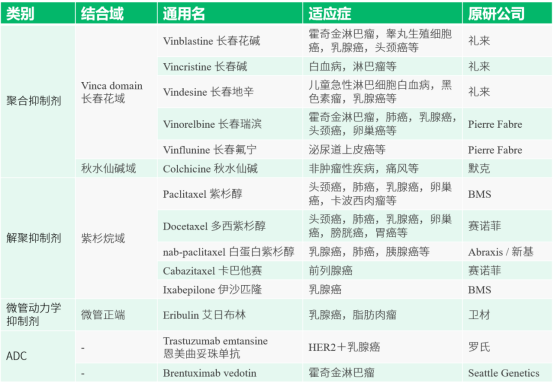
目前,长春碱和紫杉醇位点微管蛋白抑制剂类药物已在肿瘤临床治疗方面占据了重要地位,紫杉醇更是已成为肺癌、乳腺癌和卵巢癌的重要一线治疗药物。已上市的主要微管抑制剂如下图4所示。
[1] Shuai W , Wang G , Zhang Y , et al. Recent Progress on Tubulin Inhibitors with Dual Targeting Capabilities for Cancer Therapy[J]. Journal of Medicinal Chemistry, 2021, 64(12).
[2]Michel O. Steinmetz, Andrea E. Prota. Microtubule-Targeting Agents: Strategies To Hijack the Cytoskeleton[J]. Trends in Cell Biology, 2018, 28(10), 776-792
[3]Tobias Mühlethaler , Dario Gioia , Andrea E , et al. Comprehensive Analysis of Binding Sites in Tubulin[J]. Angew.Chem. Int. Ed., 2021, 60,13331–13342