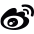前言
当前,自身免疫与炎症性疾病治疗常陷入两难境地:广谱免疫抑制剂虽然能控制炎症,但是也削弱了身体对抗真实感染的能力。有没有一种办法,既能关掉过激的炎症,又保留正常的免疫防御?
CARD9是一种在免疫细胞中传递炎症信号的关键支架蛋白,通常,CARD9功能完全丧失的变异会导致严重的真菌感染风险。然而科学家惊讶的发现,携带一种CARD9基因缺陷版本(CARD9 Δ11)的个体,不仅克罗恩病患病风险降低,且抗真菌能力并未减弱。
这一发现提示,对CARD9进行适度抑制可能实现安全抗炎。然而,CARD9作为缺乏传统活性位点的支架蛋白,长期以来被视为“不可成药”靶点。如何将这一遗传学发现转化为药物,成为一项重大挑战。
近日,哈佛医学院Ramnik J. Xavier团队基于能天然抵抗克罗恩病的CARD9 Δ11的基因变异,开发出首个靶向该蛋白的小分子抑制剂。
研究采用结合物优先(binder-first)策略:首先利用DNA编码库筛选与X射线晶体学识别出CARD9的可成药口袋,随后通过配体置换筛选获得苯二氮䓬类抑制剂。该类抑制剂可以阻止 CARD9 组装成支架结构,从而抑制其形成用于启动下游核因子κB(NF-κB)信号通路的信号小体,减少免疫细胞和人源化小鼠模型中的炎症反应,为抗炎治疗提供了新的靶向策略。
研究以“Human genetics guides the discovery of CARD9 inhibitors with anti-inflammatory activity”为题发表在《Cell》上。

研究内容
1. DEL筛选锁定苯并咪唑系列
研究人员首先使用一个包含超过224亿种分子的庞大DNA编码化合物库,对CARD9进行了一次地毯式筛查,最终找到了能结合CARD9的苯并咪唑类化合物(如化合物1)。尽管缺乏功能活性,但该系列化合物为定位CARD9上的结合位点提供了关键工具。通过SPR、HDX-MS和光亲和标记技术,将结合位点定位于CC1结构域中的一个独特“甘氨酸孔”口袋。
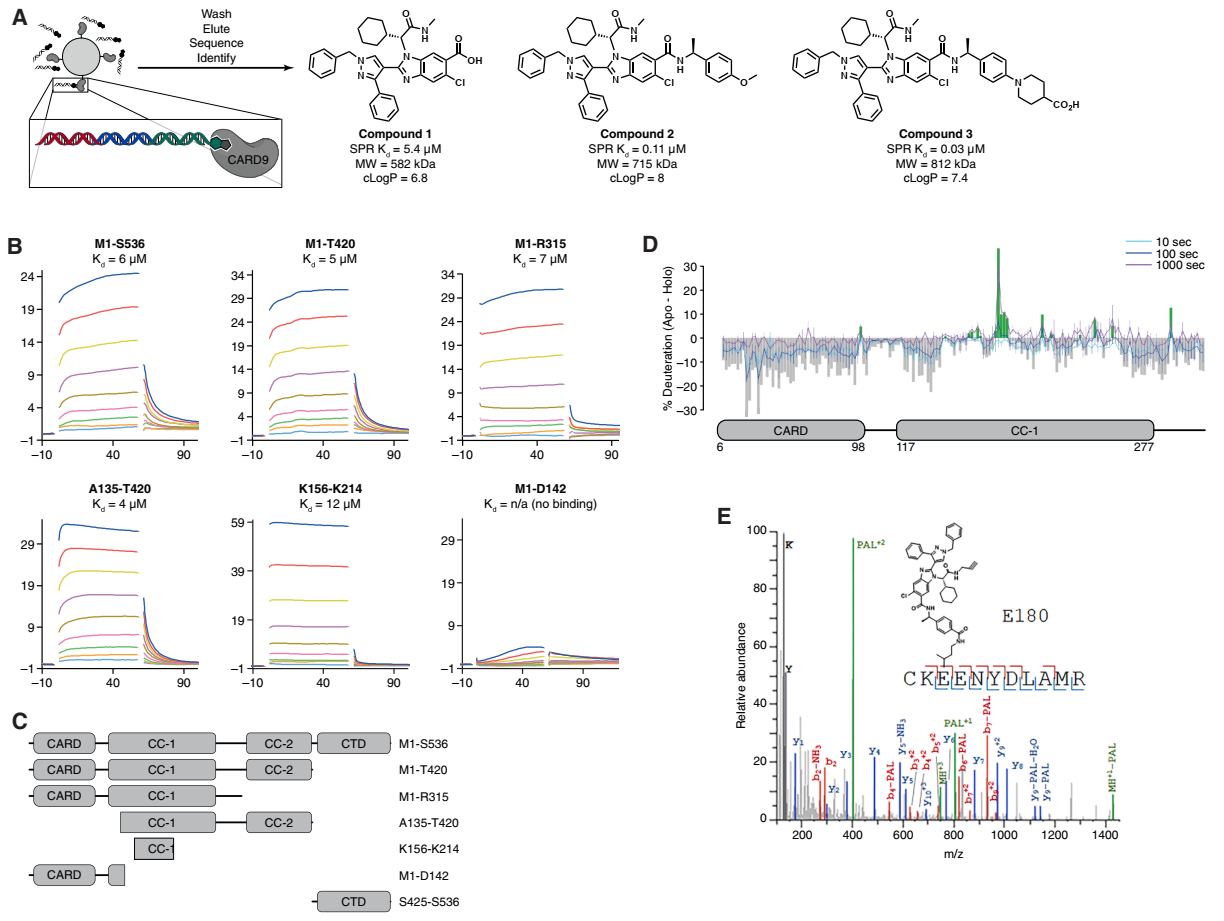
图1. CARD9结合物的发现和表征
2. 晶体学揭示结合模式
随后解析了CARD9K156-K214与化合物1的共晶结构(PDB:9AVN),首次揭示了小分子与卷曲螺旋域的结合模式,为靶向这个“不可成药”靶点提供了关键结构基础。
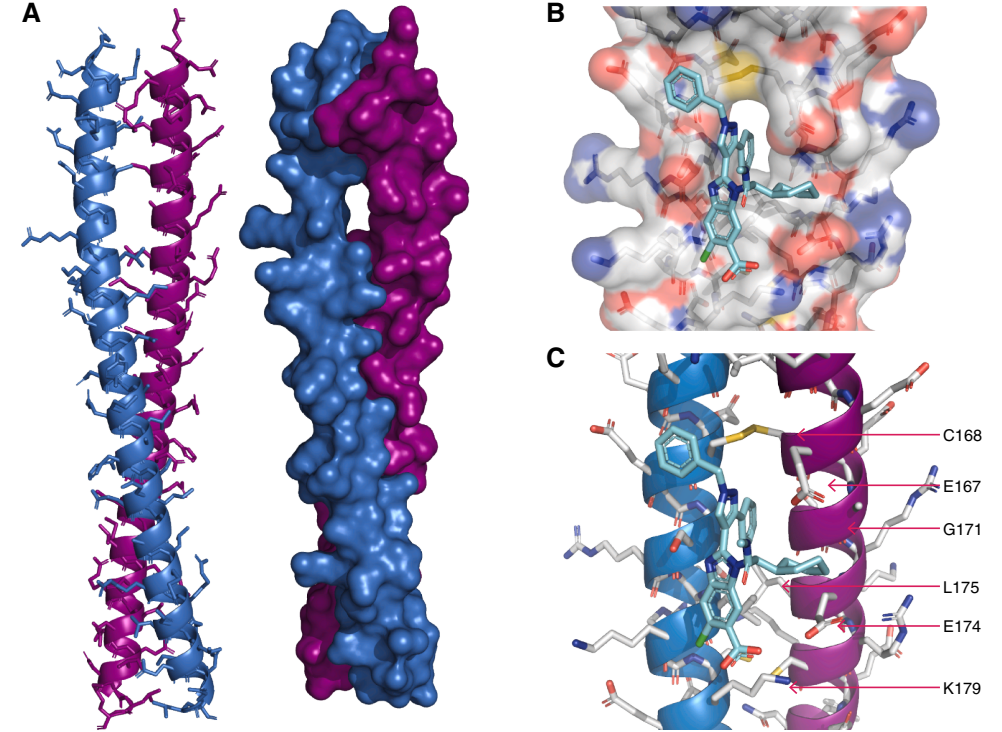
图2. 化合物1与CARD9K156-K214的X射线共晶结构
3. 创新筛选发现苯二氮䓬类功能抑制剂
鉴于初始苯并咪唑结合剂不具备功能调节活性,团队创新性地建立基于时间分辨荧光共振能量转移(TR-FRET)的配体置换筛选平台:通过对约80万分子库的筛选与多轮验证,发现了一个苯二氮䓬类化合物系列。活性对映体化合物6能有效置换探针,且在SPR实验中显示与CARD9结合,而其对映体7则无活性。值得注意的是,苯二氮䓬化合物6的抑制活性不随探针浓度增加而改变,表现为非竞争性抑制模式,提示其可能通过变构机制发挥作用。
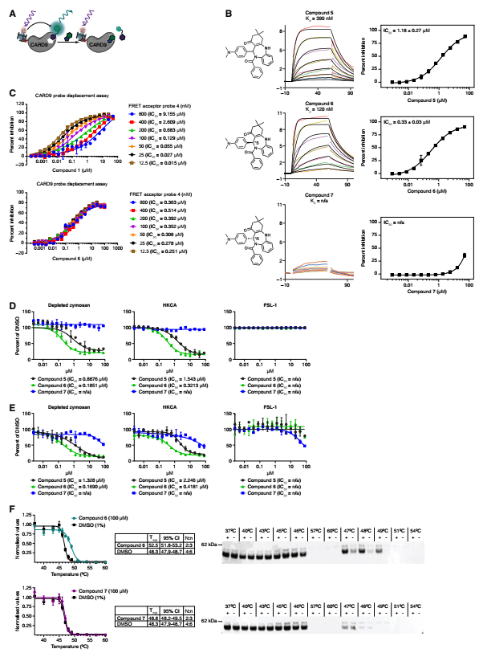
图3. 苯二氮卓类药物家族的发现、验证和初步生物活性
4. 分子机制深度解析
与仅结合CC1的苯并咪唑类不同,活性苯二氮䓬类化合物6需与CC1和CC2结构域同时结合。HDX-MS揭示其诱导蛋白多个非连续区域发生构象重排。基于生化实验和AlphaFold3建模,团队提出机制模型:CARD9静息态处于"自抑制"构象,激活时需转变为开放态以组装下游信号复合物。化合物6如同 "分子胶水" ,将CARD9锁定在非活性构象,从而抑制BCL10丝状聚合及CBM信号小体形成。
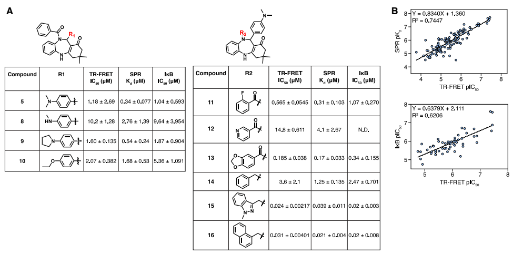
图4. 苯二氮卓类药物的严重急性呼吸系统反应
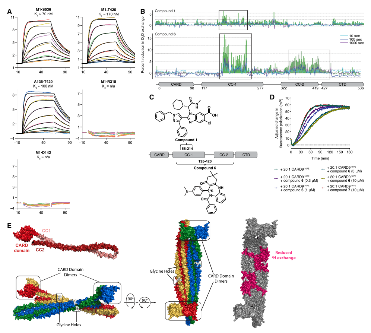
图5. 苯二氮卓类6和CARD9相互作用的性质
5. 原代细胞与体内验证
在原代人树突状细胞中,化合物6可选择性抑制真菌触发的炎症因子释放,并阻断CARD9下游的NF-κB p65磷酸化。由于小鼠CARD9的“甘氨酸孔”与人源存在序列差异,化合物无法结合。研究团队构建了人源化CARD9小鼠模型,在该模型中,化合物6能有效抑制系统性真菌感染引发的炎症因子风暴。
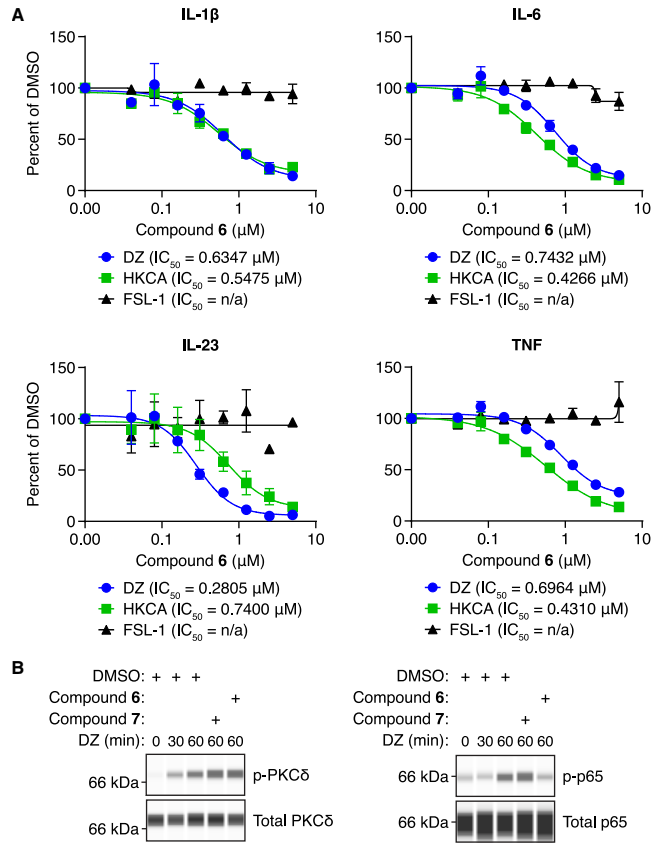
图6. 原代人类细胞中CARD9信号传导的选择性抑制及通路特异性
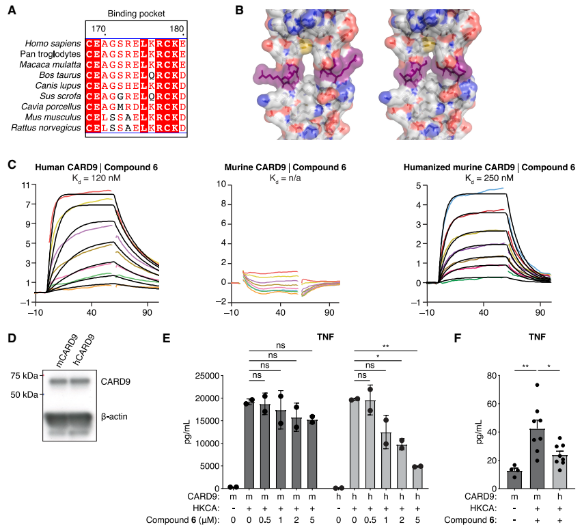
图7. 苯二氮卓类药物的体内活性
总结
该研究通过“先找结合物,再寻功能剂”的分步策略,成功攻克了CARD9这一传统“不可成药”靶点,揭示了通过稳定卷曲螺旋结构域非活性构象来调控蛋白功能的可行性。所发现的苯二氮䓬类抑制剂在细胞及人源化动物模型中均表现出良好的抗炎活性。
更重要的是,该研究展示了一套可复制的药物发现范式:从人类保护性遗传变异出发,通过高通量化筛选获得初始结合剂,再借助创新方法将其转化为功能性抑制剂,为靶向其他难成药支架蛋白提供了新思路。