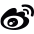前言
疱疹病毒是一类广泛存在的双链DNA病毒,可长期潜伏于人体神经细胞中,并在免疫力下降时激活复发,引发多种疾病。目前临床常用药物(如阿昔洛韦)主要靶向病毒DNA聚合酶,这类药物虽有一定疗效,但难以清除潜伏病毒,且易引发耐药性问题。因此,寻找新的抗病毒靶点迫在眉睫。
病毒复制依赖于“解旋酶-引物酶(H/P)复合体”,该复合体负责解开DNA双链并启动复制。针对该复合体的抑制剂(如pritelivir)已成为新药研发热点并进入临床应用。然而,这些药物的精确结合位点与抑制机制尚未明确,其为何仅对部分疱疹病毒(如HSV)有效,以及H/P复合体如何与DNA聚合酶协同组装成复制叉复合物,仍是该领域亟待解决的核心科学问题。
近日,哈佛医学院Jonathan Abraham团队通过高分辨率冷冻电镜技术,成功解析了单纯疱疹病毒1型(HSV-1)核心复合物的工作状态及其被抑制剂“锁死”的构象。该研究不仅阐明了解旋酶-引物酶抑制剂(HPI)的作用机制,还揭示了病毒复制机器内部多个核心组件如何精密装配、协同工作的全新细节,为开发更高效、更广谱的抗疱疹病毒药物奠定了坚实的结构基础。
该研究以“Mechanisms of HSV-1 helicase-primase inhibition and replication fork complex assembly”为题发表在《Cell》上。

研究内容
HSV-1 H/P复合物的结构
研究人员首次揭示了HSV-1 H/P复合体的高分辨率结构。冷冻电镜结构显示,该复合体以UL52引物酶为核心,UL5解旋酶与UL8辅助蛋白分居两侧。UL52的AEP样结构域与锌指结构域位于DNA出口的同一侧,为“先解旋,后引物”提供了合理的空间路径。
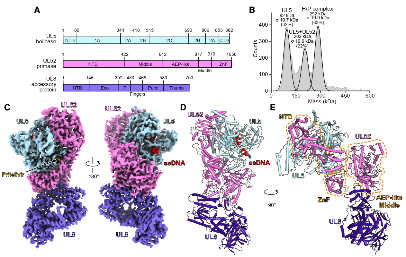
图1. pritelivir结合的HSV-1解旋酶-引物酶复合体整体结构
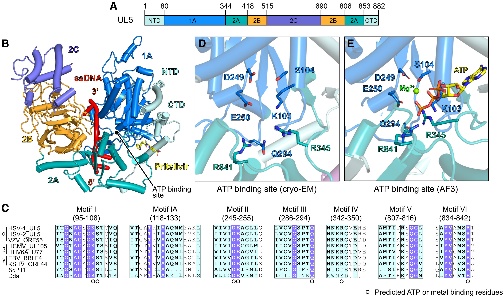
图2. HSV-1 UL5解旋酶结构域与ATP结合位点
HPIs的抑制机制
研究分别解析了复合体与三种抑制剂(pritelivir、IM-250、阿米那韦)结合的结构。结果显示,三种抑制剂均结合在UL5的1A与2A结构域界面与UL52的NTD及中间结构域形成的口袋中。药物结合后,阻止了UL5中1A与2A结构域的闭合,从而抑制了ATP水解与DNA解旋所需的构象变化。
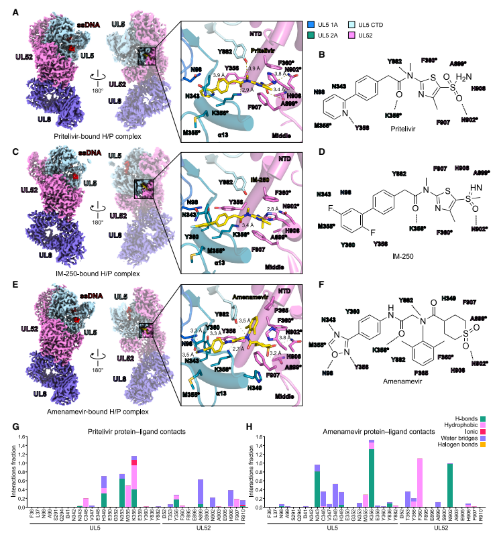
图3. HSV-1 HPI结合模式
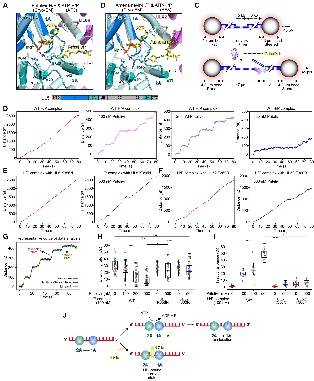
图4. HPIs将H/P复合物锁定在无活性构象中,并使其在DNA上的活性暂停
HPI 选择性与耐药性机制
HPIs对α-疱疹病毒(如HSV-1、VZV)有效,但对β-疱疹病毒(如HCMV)无效。序列分析表明,UL52区域在不同疱疹病毒亚型间差异较大,影响了药物结合。
研究进一步揭示,已知的临床耐药突变(如UL5 K356N、UL52 F360C)直接位于药物结合口袋,通过破坏关键相互作用或产生空间位阻来削弱药物结合。
复制叉复合体的组装与结构
研究成功组装并解析了HSV-1复制叉复合体(H/P +聚合酶+DNA)的结构:UL30的FYNPYL 保守基序与 UL5的2B/2C域直接相互作用,这个界面在之前是完全未知的。
为了验证这个界面的功能重要性,研究人员将UL5上与FYNPYL基序相互作用的四个关键残基全部突变为丙氨酸。结果显示,突变体无法有效组装成完整的复制叉复合物,其DNA合成能力也严重受损。这证明该界面对于病毒基因组的有效复制至关重要。
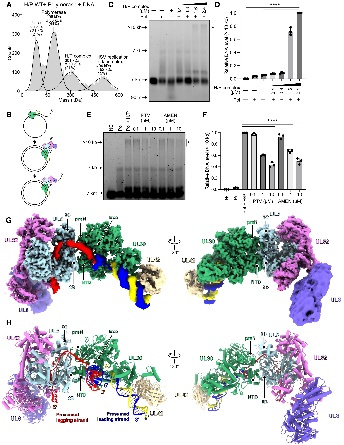
图5. HSV-1复制叉复合物与DNA结合的结构
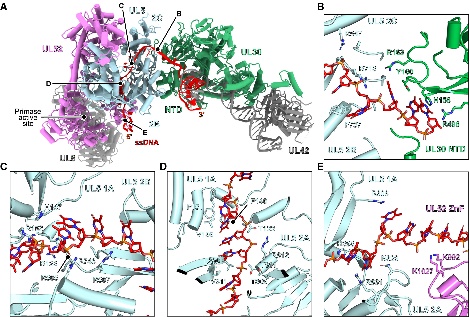
图6. 复制叉复合物与DNA的相互作用
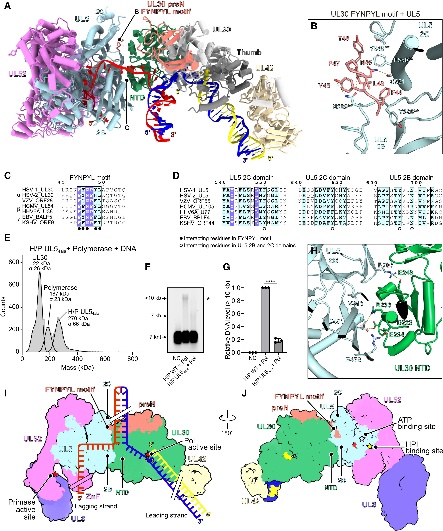
图7. 疱疹病毒特异性FYNPYL 基序参与复制叉复合物组装
总结
这项研究揭示了抗疱疹病毒药物的全新作用机制,并破解了病毒复制机器的组装密码。研究发现,药物并非直接攻击酶的活性中心,而是通过别构抑制,巧妙地“锁死”了解旋酶的关键运动关节,使其丧失功能。同时,研究首次发现,病毒复制所需的两大核心组件——解旋酶与DNA聚合酶——是通过一个名为“FYNPVL”的保守分子接头实现精密对接的,这一发现阐明了它们如何协同完成高速复制。
冷冻电镜技术在本研究中起到了决定性作用。它如同分子世界的“超高分辨率动态相机”,不仅捕捉到药物结合的精确位点,更揭示了其如何诱导解旋酶构象“冻结”。更重要的是,该技术成功解析了高度动态且不稳定的完整病毒复制叉结构,首次呈现出这个复制“超级机器”的全貌与组装原理。这些发现不仅从原子层面解释了现有药物的作用机制与选择性局限,也为设计能阻断复制叉组装的新一代广谱抗病毒药物提供了精准的路线图。