目前,PPARs激动剂在临床治疗多种疾病方面取得了显著的成果。由于对代谢调节的关键作用和良好的成药性,许多PPARs激动剂已被开发用于治疗代谢性疾病,特别是血脂异常和II型糖尿病。
青云瑞晶已完成PPARα与PPARγ蛋白靶点的蛋白表达和结构解析,成功解析了复合物结构。基于这些实验条件和库存蛋白,青云瑞晶将项目的交付时间缩短至1-2个月,并确保项目的成功交付。
蛋白表达和结构解析结果详见文末!
关于 PPARs
01. 靶点简介
过氧化物酶体增殖物激活型受体( peroxisome proliferator activated-receptors, PPARs)是一类由配体激活的核转录因子,属于受体超家族成员。最早由Isseman和Green从小鼠肝脏克隆得到[1]。PPARs分为三种亚型,PPARα、PPARβ/δ与PPARγ[2]。PPARs 在许多慢性病中的作用已得到证实,如糖尿病、癌症、炎症和动脉硬化等[3-5],它在调控脂质和葡萄糖以及能量平衡方面发挥着重要作用[6]。
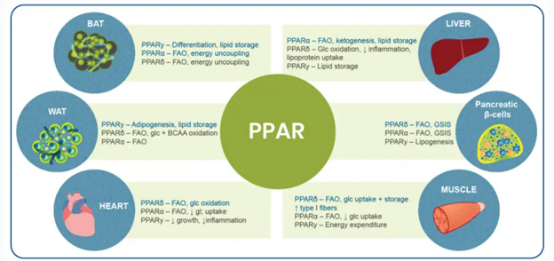
图1. PPARs在细胞表达水平
▶ PPARα 简介
PPARα 是目前降脂药物的靶点之一,主要表达于肝脏、心脏及棕色脂肪组织中,同时也是脂肪酸氧化途径中的主要活化剂成分。PPARα 的激活导致血脂水平下降和血浆中甘油三酯的消除,从而导致高密度脂蛋白胆固醇水平升高。此外,其参与葡萄糖稳态和胰岛素抵抗的发展也已被证实。在肝脏中,PPARα 控制脂质代谢,如摄取、活化和氧化脂肪酸、脂肪分解、生酮作用和甘油三酯的储存。它的配体激活也催化脂肪酸的羟基化。PPAR 的激活进一步通过将肝脏胆固醇转化为高密度脂蛋白来降低高密度脂蛋白水平,从而降低肝脏极低密度脂蛋白。因此,它的激活剂通过降低血浆中甘油三酯水平和增加高密度脂蛋白胆固醇在治疗血脂异常中发挥重要作用。
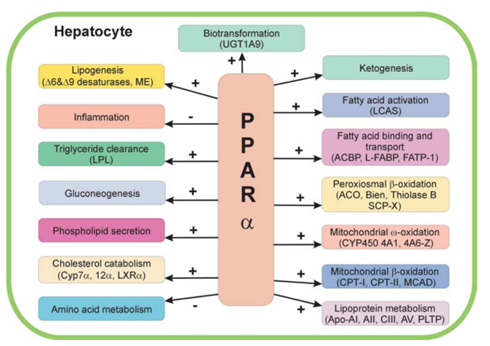
图2. PPARα在肝细胞中作用[7]
▶ PPARβ/δ 简介
PPARβ/δ在多个组织中表达,不仅参与脂肪酸的氧化,还参与伤口的修复、角质细胞的分化和脂肪的生成。与 PPARα和 PPARγ一样,PPARβ/δ也是不饱和脂肪酸的受体。PPARβ/δ在所有细胞中表达,但在骨骼肌和巨噬细胞中表达最高,它的激活可以提高导致胰岛素敏感性,脂降低蛋白脂肪酶活性,抑制低密度脂蛋白的形成。同时,PPARβ/δ的激动剂在治疗肥胖症、糖尿病和动脉粥样硬化等疾病中也发挥了重要的作用,可以使脂质正常化从而降低心血管疾病的风险。此外,PPARβ/δ在结肠癌、前列腺癌和乳腺癌中的作用也引起人们的广泛关注。
▶ PPARγ 简介
PPARγ主要在白色和棕色脂肪组织、结肠粘膜、盲肠、系膜细胞、血管平滑肌细胞和内皮细胞中表达。PPARγ在脂肪组织中大量表达,并且在脂肪生成中起着核心作用。由于 PPARγ基因有独立的启动子和 5’的外显子,它产生了三种mRNA,即PPARγ1、PPARγ2 和 PPARγ3。由 PPARγ1 和 PPARγ3 的mRNA经过翻译后产生了相同的蛋白质,而PPARγ2 的产物含有一个额外的由30 个氨基酸组成的NH2-末端区域。尽管所有的 PPARγ异构体都在脂肪细胞分化和葡萄糖代谢中发挥着重要作用,但是它们的表达并不相同。PPARγ1 异构体几乎在所有细胞中都有表达,而 PPARγ2 却主要限于脂肪组织,两种形式的 PPARγ1 和PPARγ2 对于脂肪组织的发育和胰岛素敏感性的调控都是必不可少的。脂肪组织的PPARγ可保护非脂肪组织免受过度的脂质过载影响,同时可以维持器官的正常功能。脂肪细胞中被激活的 PPARγ保证了脂肪细胞因子的分泌和平衡,这些因子是胰岛素在外周的作用的媒介,因此,整个身体的胰岛素敏感性得以保持。此外,PPARγ在脂质代谢中也发挥了重要作用,它可以调控脂肪酸的释放、运输和储存,如脂蛋白脂肪酶和脂肪酸转运体 CD36 等。
PPARγ是强有力的功能调节器,不仅在脂肪组织中发挥作用,在内皮细胞和血管平滑肌细胞中也发挥着重要作用。在内皮细胞中,它参与调节与炎症和动脉粥样硬化病变。
除此之外,PPARγ也参与调节癌症的发展,它的激动剂可以抑制或促进癌症的生长,这取决于细胞的条件以及受刺激的信号通路。
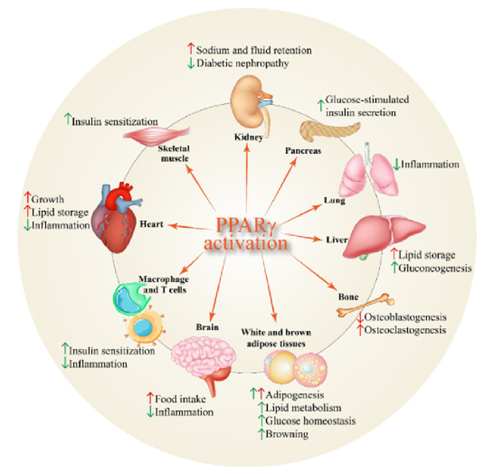
图3. PPARγ 在体内的生理作用示意图[8]
02. PPARs 结构
与其余大多数核受体的基本结构相似,PPARs 的模块化结构有4 个功能域: A/B,C,D,和 E/F。A/B 结构域位于 N 端,具有配体无关的激活功能区 1 (AF-1),负责 PPARs 的磷酸化。C 结构域的结构高度保守,由 2 个锌指组成,是 PPAR 靶基因启动子中的过氧化物酶体增殖反应元件(PPRE)结合位置,因此又称为 DNA 结合域(DBD)。D 结构域为各种辅因子提供了结合位点。E/F 结构域为配体结合域(LBD),在该结构域中 13 个 α螺旋和 1 个小的 4 链 β-薄片组成 Y 形的疏水口袋,以结合内源性或外源性的亲脂配体。另外,在 LBD的 C 端还存在有配体依赖性激活域(AF-2),该结构与参与转录过程的 PPARs 辅助因子结合袋的形成密切相关。
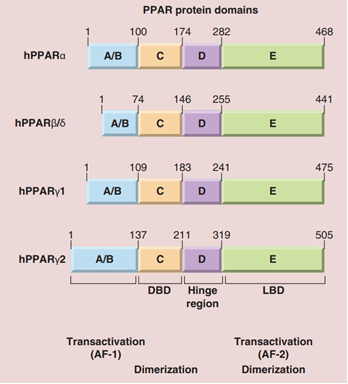
图4. PPARs结构示意图[9]
03. PPARs信号通路
PPARs的转录活性不仅依赖于PPRE,还需要类视黄嘌呤-x受体(RXR)的参与。PPARs可以被许多天然或合成的PPAR配体激活,配体结合的PPARs与维甲酸类X受体(RXR)结合形成异二聚体,进而促进协同因子的招募和抑制因子的释放。协同因子与PPAR/RXR二聚体在下游基因的启动子区域结合,对下游的基因起到调节转导的作用,这些基因主要涉及脂质和葡萄糖代谢、炎症和癌症等。此外,PPARs可以在不与DNA结合的情况下对基因的表达进行负向调节,比如直接抑制其他转录因子的活性,如在炎症反应中竞争抑制NF-ΚB、激活蛋白-1(activator protein-1,AP-1)、JAK-STAT等途径,起到抑制炎症反应的作用(如图5所示)。
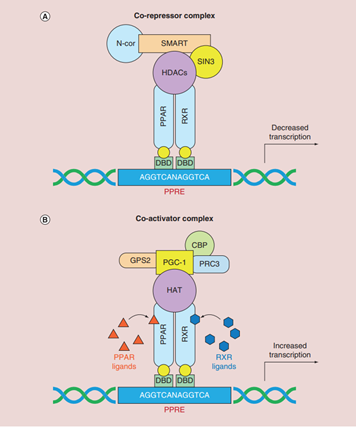
图5. PPAR 介导的基因调控[9]
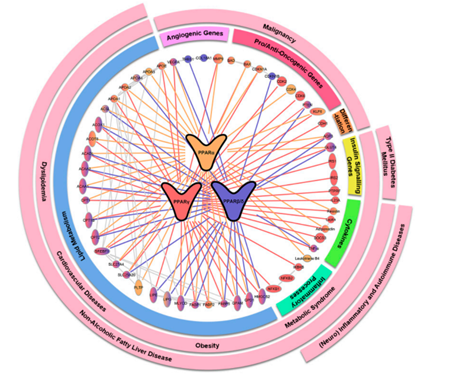
图6. PPARα 、 γ 和 β/δ下游的关键靶基因和相互作用蛋白[10]
04. PPARs 药物发展
目前, PPARs已经作为一个重要的药物筛选靶标用于治疗肥胖症,糖尿病和癌症等。PPARs激动剂在临床治疗多种疾病方面取得了显著的成果。由于PPARs对代谢调节的关键作用和良好的成药性,许多PPARs激动剂已被开发用于治疗代谢性疾病,特别是血脂异常和II型糖尿病。
临床批准用于治疗血脂异常的PPARs激动剂主要包括:Fenofibrate(PPARα激动剂), Bezafibrate(PPARγ激动剂), Gemfibrozil(PPARα激动剂)。临床上用于治疗II型糖尿病的PPAR激动剂主要包括:Balaglitazone(PPARγ激动剂);Pioglitazone HCl(PPARγ激动剂);Rosiglitazone(PPARγ激动剂)。
然而,开发新型PPAR激动剂的过程中,一个主要挑战是如何降低药物可能带来的副作用。未来PPARs的研究将聚焦于两大方向:一是通过创新手段减少PPARs激动剂的非特异性作用;二是积极探索PPARs潜在的拮抗剂。
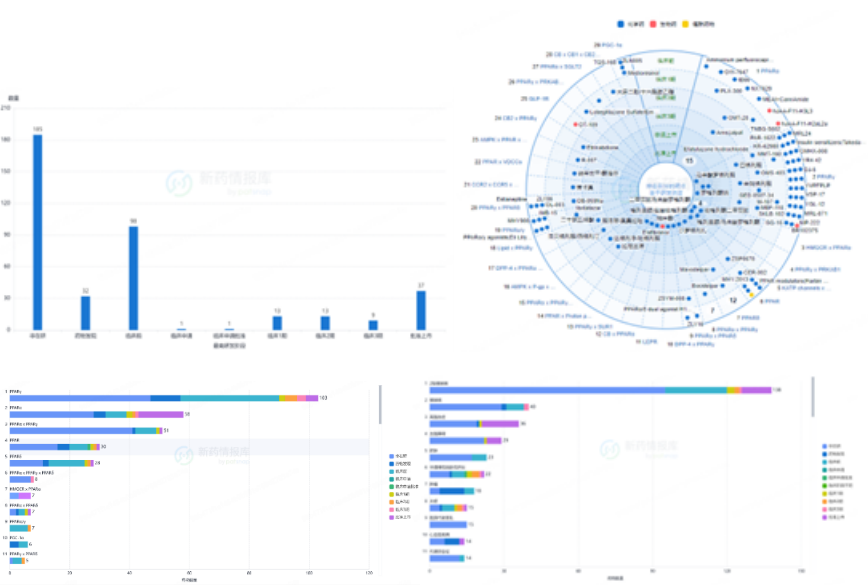
图7. PPARs药物研发进展
(来源:https://synapse.zhihuiya.com)
PPARs 实验结果展示
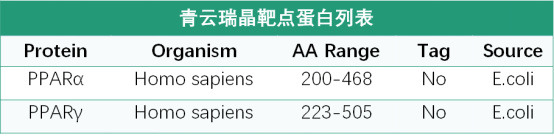
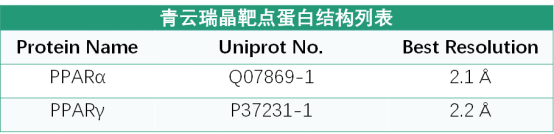
PPARα_200-468
▶ 蛋白纯化结果(周期:现货或者1周)
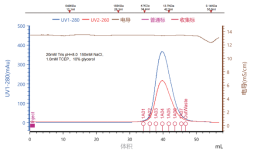
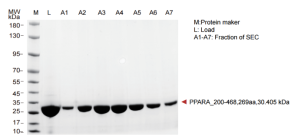
▶ 结晶和结构解析(周期:1-2周)

PPARα 晶体

PPARα 晶体衍射
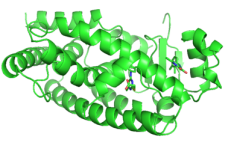
PPARα 三维结构
PPARγ_223-505
▶ 蛋白纯化结果(周期:现货或者1周)

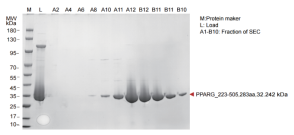
▶ 结晶和结构解析(周期:1-2周)

PPARγ 晶体
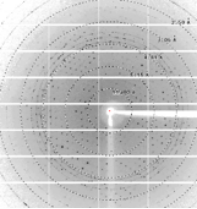
PPARγ 晶体衍射
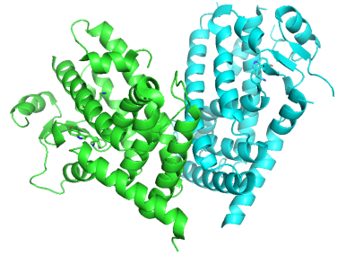
PPARγ 三维结构
「青云瑞晶」提供专业的结构解析技术服务,自拥有单晶X射线衍射(XRD)、冷冻电镜单颗粒法(CryoEM-SPA)、MicroED 三种结构解析技术平台,根据蛋白质的不同性质,提供不同的解决方案,结合精良高端的实验设备、经验丰富的高学历科研团队,为您提供从蛋白表达开始的一站式结构解析服务,灵活多样化满足您的多种科研及工业界需求。
★ 参考文献
[1] Issemann I,Green S. Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators[J]. Nature,1990,347(6294):645-50.
[2] Bougarne N,Weyers B,Desmet S J,et al. Molecular Actions of PPARα in Lipid Metabolism and Inflammation[J]. Endocrine Reviews,2018,39(5):760-802.
[3] Ngala R A, Stocker C J, Roy A G, et al. A new, highly selective murineperoxisome proliferator-activated receptor δ agonist increases responsiveness to thermogenic stimuli and glucose uptake in skeletal muscle in obesemice[J]. Diabetes Obes Metab. 2011, 13(5): 455-464.
[4] Yu B C, Chang C K, Ou H Y, et al. Decrease of peroxisome proliferator- activated receptor delta expression in cardiomyopathy of streptozotocin-induced diabetic rats[J]. Cardiovasc Res. 2008, 80(1): 78-87.
[5] Grygiel-Górniak B. Peroxisome proliferator-activated receptors and their ligands: nutritional and clinical implications--a review[J]. Nutr J. 2014, 13:17.
[6] Towfighi A, Ovbiagele B. Partial peroxisome proliferator-activated receptor agonist angiotensin receptor blockers. Potential multipronged strategy in strokeprevention[J]. Cerebrovasc Dis. 2008, 26(2): 106-112.
[7] S. Mandard, M. Müller and S. Kersten. Peroxisome proliferator-activated receptor a target genes[J]. Cell. Mol. Life Sci. 2004, 61,393–416.
[8] KHOSROPOOR S, ALAVI M S, ETEMAD L, ROOHBAKHSH A. Cannabidiol goes nuclear: The role of PPARgamma [J]. Phytomedicine, 2023, 114: 154771.
[9] Lu Han, Wen-Jun Shen, Stefanie Bittner. PPARs: regulators of metabolism and as therapeutic targets in cardiovasculardisease. Part I: PPAR-α [J]. Future Cardiol. 2017,13(3), 259–278.