01.成果简介
2025年3月5日, 中国科学院天津工业生物技术研究所高书山团队与杭州师范大学/湖北大学郭瑞庭团队等合作在Nature上在线发表了题为Chanoclavine synthase operates by an NADPH independent superoxide mechanism 的科研论文。
该研究以参与麦角生物碱生物合成、O2依赖性过氧化氢酶EasC为研究对象,通过冷冻电镜解析了其独特的底物结合模式,利用大量生化与波谱学实验表征了整个O2激活途径的电子传递和氧原子同化反应原理,揭示了一种利用活性氧超氧阴离子催化天然药物分子的生物合成机制,对理解包括过氧化氢酶在内的血红素酶催化机制具有重要理论突破。
02.背景介绍
麦角生物碱包括70多种来自真菌和植物的天然产物,以及许多半合成产物。这些生物碱作为各种肾上腺素能、5-羟色胺能和多巴胺能受体的激动剂或拮抗剂,影响生理系统,如血管平滑肌、中枢神经系统和内分泌系统。这种广泛的作用是它们用于治疗疾病的基础,例如急性偏头痛、产后出血、高催乳素血症、帕金森病和阿尔茨海默病。
麦角生物碱可用于治疗各种疾病,因构成其核心药效团的中央C环与神经递质结构相似,从而使它们可以调节神经递质受体。Chanoclavine Synthase(EasC)通过复杂的自由基氧化环化催化这一环的形成,此前认为EasC的催化机制与P450s类似,涉及化合物I引发的氧化环化,但因其与典型过氧化氢酶在轴向配体等结构上存在差异,该机制存在疑问。在金属酶催化的依赖氧气反应中,传统的“金属-氧”模式是酶利用血红素铁将氧气还原为铁-氧复合物来转化底物,底物结合在血红素上方且反应在同一口袋发生。而本研究旨在探索EasC的真实催化机制,为深入理解麦角生物碱生物合成及金属酶催化反应提供依据。
03.图文概览

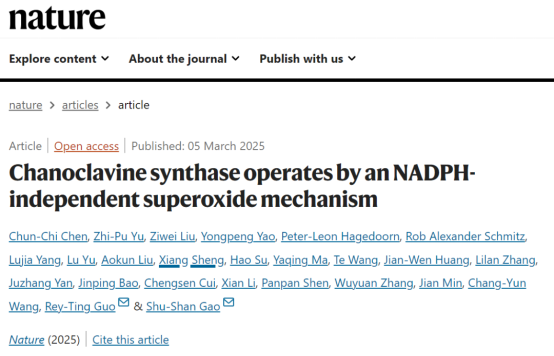
研究人员运用单颗粒冷冻电镜技术,成功解析了来自Claviceps fusiformis的EasC结构,分辨率达2.64Å。EasC呈现典型的过氧化氢酶折叠,拥有保守的血红素结合口袋、NADPH结合口袋以及由八链反平行β-桶形成的疏水核心。它以同二聚体形式存在,与典型的四聚体过氧化氢酶不同。
使用冷冻电镜进一步解析了EasC-PCC复合物,分辨率为2.33 Å,结果显示PCC结合在NADPH结合口袋中,而非此前推测的血红素口袋,且在二者之间存在一个11.6 Å 的隧道将二者连接在一起,并促进活性氧的转移(图2)。
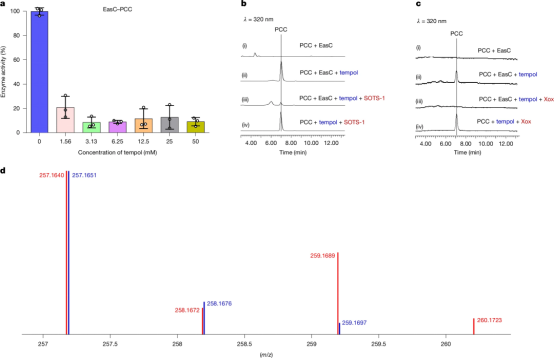
04.结果讨论
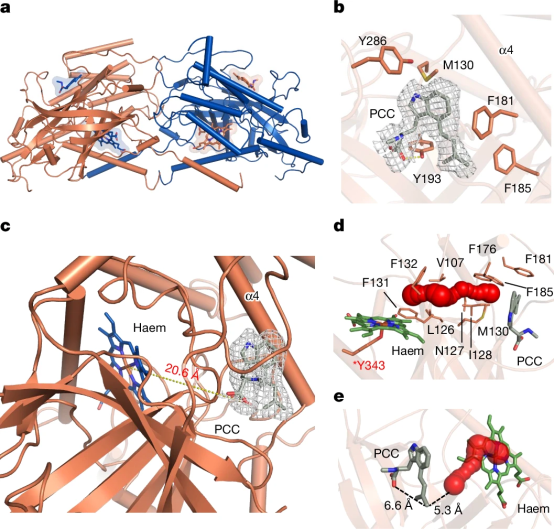
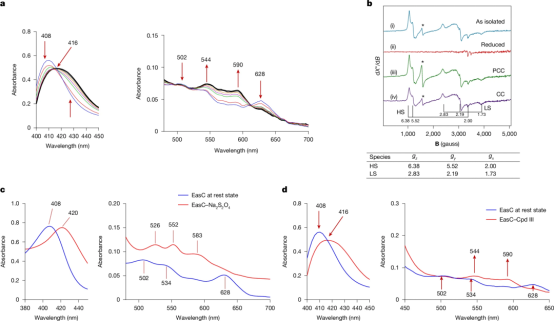
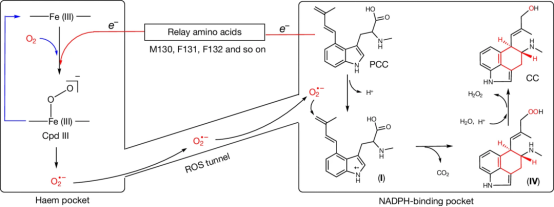
本研究借助冷冻电镜解析EasC的结构,揭示了一种特殊的超氧化物机制。与已知的血红素酶不同(这些酶通常利用铁 - 氧中间体,即Cpd I、II 和 III 来激活并完成反应),EasC使用 Cpd III 分解产生的超氧化物来介导两个遥远口袋的协同催化。
在这种机制中,与羟基自由基相比相对温和的游离超氧化物可以在两个不同的口袋之间穿梭,实现无缝协作。此外,底物不再需要直接与金属中心和氧气相互作用,因为氧气的活化和底物的转化分别发生在不同的口袋中。这种分离不仅极大地拓展了底物转化的三维空间,还能够对多步自由基氧化环化反应进行精确调控。
总之,两个相距较远的口袋之间特殊的功能协作,为这种新的超氧化物机制提供了结构基础,使得 EasC 能够在药用麦角生物碱的生物合成过程中进行如此复杂的氧化环化反应。该机制为理解金属酶催化反应提供新视角,也为麦角生物碱生物合成研究提供重要依据。