DYRK1A(Dual-Specificity Tyrosine Phosphorylation-Regulated Kinase 1A)是一种丝氨酸/苏氨酸激酶,属于CMGC蛋白激酶家族。DYRK1A的异常表达或过度激活与多种疾病的发生发展有关,包括AD。在AD的发病机制中,DYRK1A能够磷酸化tau蛋白,导致其聚集和纤维化,同时还能够加速β/γ分泌酶介导的淀粉前体蛋白(APP)的裂解,产生毒性的Aβ肽。因此,DYRK1A被认为是AD治疗的一个有前景的靶点。
结构解析技术服务是青云瑞晶的核心业务,我司搭建了全面的结构解析技术平台,并基于数年的结构生物学项目经验,自建了以靶点蛋白为核心的重组蛋白产品库,不断拓展产品累积,为工业及科研用户提供优质的一站式服务。
7月24日,沈阳药科大学赵庆春教授研究团队、贾景明教授研究团队与徐子华教授研究团队共同在《Journal of Medicinal Chemistry》上,发表了关于一种新的、强效、选择性的DYRK1A抑制剂的研究。

该抑制剂被证明有很好的抑制效力、激酶选择性以及体外和体内吸收、分布、代谢和排泄(ADME)特性。有望成为探索AD治疗和作用机制的有价值的分子工具。
化合物筛选与优化: 通过合理设计和系统结构优化,研究人员鉴定出化合物32(即ZJCK-6-46),它对DYRK1A具有高抑制活性(IC50=0.68 nM)。
体外评估: 化合物32表现出良好的吸收、分布、代谢、排泄(ADME)特性,并且在Tau (P301L) 293T细胞和SH-SY5Y细胞中显著降低了p-Tau Thr212的表达。
体内实验: 在小鼠模型中,化合物32显示出良好的生物利用度、血脑屏障渗透性以及改善认知功能的潜力。通过减少磷酸化tau蛋白的表达和神经元损失来实现这一点。
药代动力学研究: 单次静脉注射后,化合物32显示出可接受的分布、半衰期和平均驻留时间。单次口服给药后,化合物32显示出了适度的脑组织/血浆分配系数(Kp(brain/plasma)),表明它可以穿过血脑屏障并在大脑中积累。
安全性评估: 急性毒性研究表明,单次口服给药剂量高达500 mg/kg时,化合物32未导致小鼠死亡,也没有引起体重或主要器官重量的显著变化。
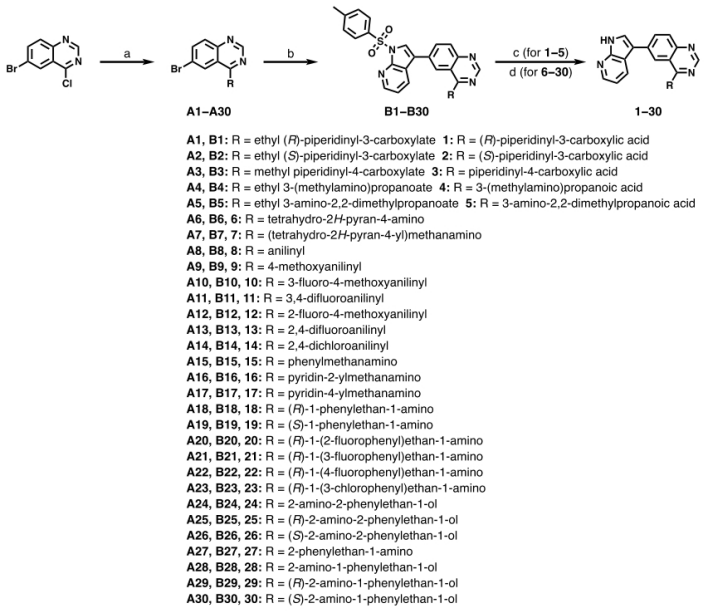
01.化合物的合成
通过亲核取代反应、Suzuki偶联反应等步骤,得到的一系列中间体和最终化合物。
02.结构-活性关系(SAR)研究与先导化合物发现
本节详细探讨了化合物结构变化对其作为双特异性酪氨酸磷酸化调控激酶1A(DYRK1A)抑制剂活性的影响,以及如何通过这些变化识别出具有开发潜力的先导化合物。

初步SAR探索:通过引入不同末端羧酸片段的化合物,研究者发现了具有优异激酶结合亲和力和良好LLE的潜在候选分子。
羧酸片段的影响:研究发现,哌啶羧酸片段的构型变化对DYRK1A抑制活性影响不大,而异哌啶羧酸衍生物显示出更强的抑制活性和更高的LLE。
其他片段的尝试:尝试用直链3-氨基丙酸片段替换异哌啶羧酸片段,结果发现某些化合物虽然保持了抑制活性,但其亲脂性降低。
苯胺衍生物的研究:苯胺衍生物的引入显著增加了亲脂性,但也导致了LLE的不利变化。研究表明,苯环上的卤素取代对抑制活性和亲脂性都有影响。
连接链长度的探索:通过合成不同长度的苯乙胺取代物,研究者发现增加连接链长度可以提高抑制活性,但也会增加亲脂性。
03.激酶选择性提升与结合模式分析
在合成的30个化合物中,找得具有良好的激酶结合亲和力、中等的亲脂性和良好的配体亲脂性效率(LLE)的潜在先导化合物12、26和29。接下来针对候选化合物提高DYRK1A抑制剂的选择性并分析其与激酶的结合模式。
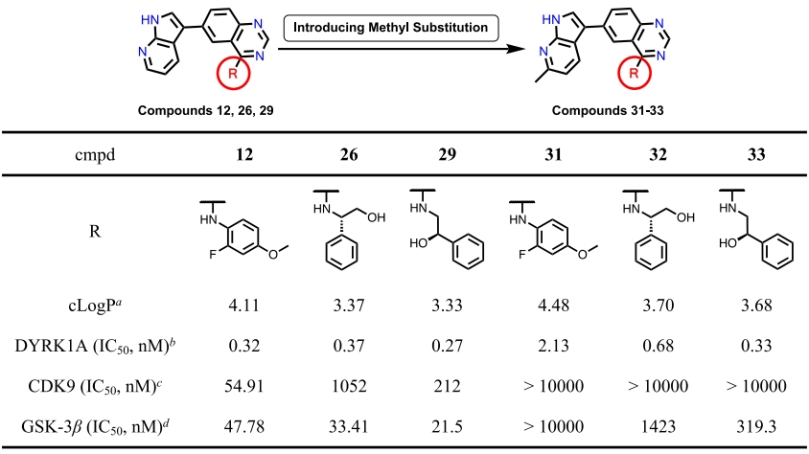
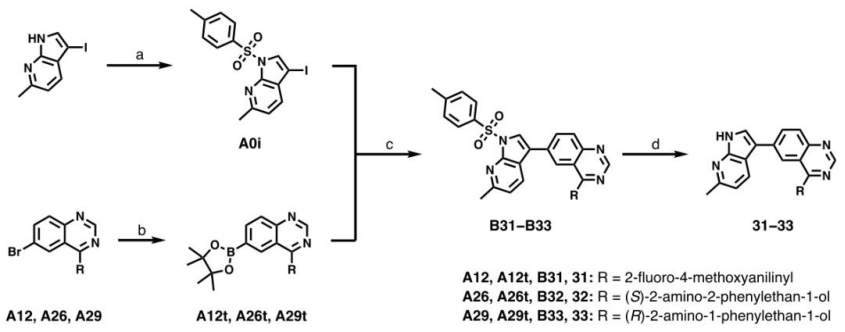
结构修饰:研究者通过在咪唑啉酮片段的氮原子上引入甲基,得到了化合物30、31和32,这些化合物在保持对DYRK1A强抑制活性的同时,显著提高了对糖原合成酶激酶3β(GSK-3β)的选择性。
选择性分析:在激酶面板分析中,化合物32对215种蛋白激酶的抑制活性进行了评估,结果显示除了DYRK家族成员和高度同源的CLK激酶外,大多数激酶的活性抑制均低于30%,其中对DYRK1B的抑制活性最强。
ADP-Glo分析:通过ADP-Glo分析进一步验证了化合物32对其他DYRK和CLK激酶的抑制效果,特别是对CLK1和CLK4的抑制作用较弱。
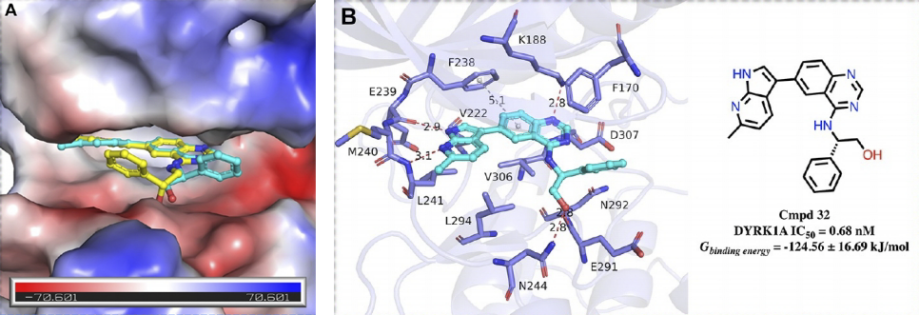
分子对接:分子对接研究揭示了化合物32与DYRK1A的结合模式,显示化合物32能与DYRK1A的关键残基形成氢键,并与催化口袋中的芳香族氨基酸形成π-π堆积相互作用。
动力学模拟:200纳秒的分子动力学模拟进一步证实了化合物32与DYRK1A结合的稳定性,并比较了化合物32和33与DYRK1A的结合自由能,发现化合物33的结合自由能更低,表明其与DYRK1A的结合更稳定。
CYP酶抑制:体外CYP酶抑制实验表明,化合物32对四种CYP酶有较弱的抑制作用,但对CYP2C9和CYP2C19的抑制作用较强,这提示了潜在的药物-药物相互作用风险。
04.化合物31、32、33在人肝微粒体和人血浆中的体外代谢稳定性、与人血浆蛋白的结合、血脑屏障的渗透性和细胞渗透性,以及化合物32对细胞色素P450酶的抑制
评估了化合物31、32和33的一系列药代动力学特性以及化合物32对细胞色素P450酶的抑制作用。
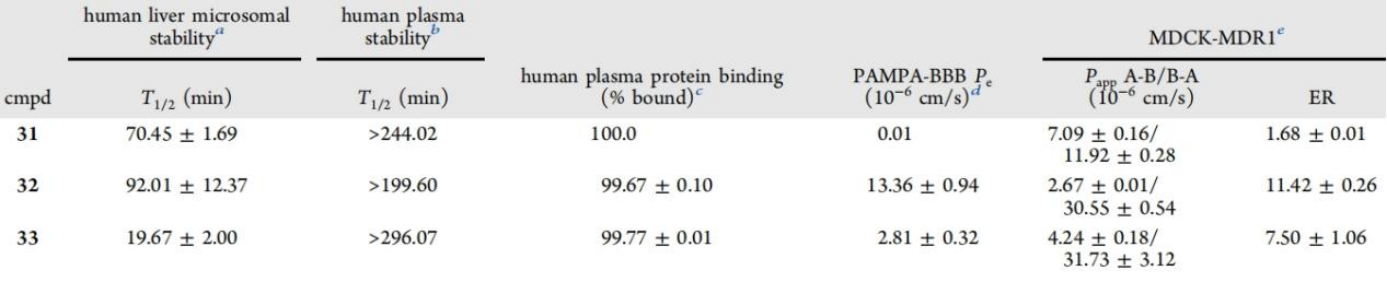
代谢稳定性:化合物31和32在人肝微粒体中表现出中等程度的代谢稳定性,而化合物33则较为敏感。所有化合物在人血浆中的稳定性都很好,其半衰期超过199分钟。
血浆蛋白结合:所有化合物在人血浆中都显示出极高的血浆蛋白结合率,5小时后的结合分数值超过99%。
血脑屏障渗透率:化合物32在体外平行人工膜渗透实验(PAMPA-BBB)中显示出高血脑屏障渗透率,而化合物31和33的渗透率较低或不确定。
细胞渗透性:所有化合物在MDCK-MDR1细胞实验中表现出中等的细胞渗透性,且化合物31没有显示出P-糖蛋白(P-pg)外排泵的底物特征。

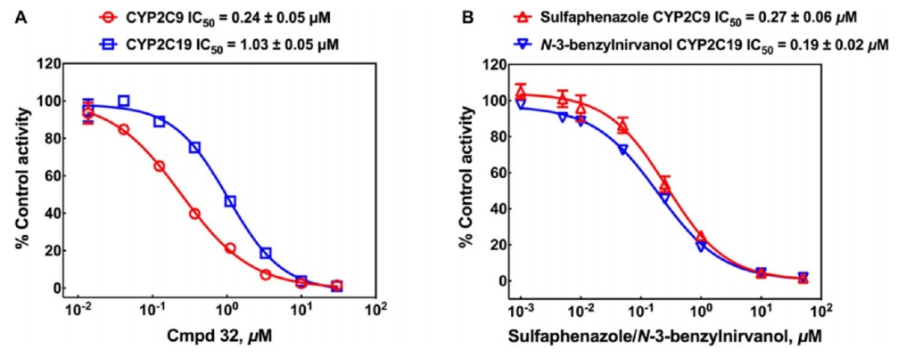
CYP酶抑制:化合物32对六种主要人CYP酶中的四种表现出较弱的抑制作用,但对CYP2C9和CYP2C19的抑制作用较强,这可能预示着与这些CYP酶底物和代谢产物的潜在药物-药物相互作用。
05.基于计算的化合物32密度泛函理论(DFT)研究
使用密度泛函理论(DFT)计算方法对化合物32的电子特性进行了深入分析。
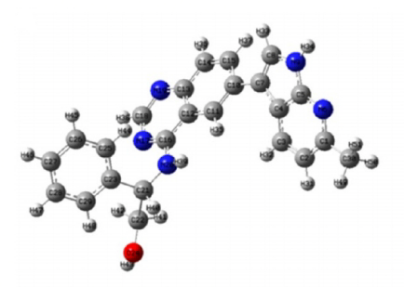
几何结构分析:使用M06-2X/6-311G(2d,2p)优化水平对化合物32进行了高精度的结构优化,得到了其最稳定的几何构型。
分子静电势分析:通过分子静电势(MEP)分析,发现化合物32表面存在明显的正负极性区域,表明其可能具有较强的亲电性和亲核性。
前沿分子轨道分析:前沿分子轨道(FMO)分析揭示了化合物32的最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)之间存在较大的能隙,暗示了其具有较高的化学稳定性。
全局反应性指数:通过概念密度泛函分析,计算了化合物的全局反应性指数,包括穆伦尼科夫电负性、化学势、硬度、软度、亲电性和亲核性指数,以及福库函数分析,揭示了化合物32的电子活性和反应性。
N原子反应活性:福库函数分析进一步探讨了分子中每个原子的电子活性,发现化合物32的亲电区域主要集中在喹唑啉片段,特别是某些原子显示出较高的亲核反应性。
N原子亲核性:计算得到的凝集局部亲核性指数表明,整个6-(1H-吡咯[2,3-b]吡啶-3-基)喹唑啉骨架上的N原子也显示出较高的亲核性。
化学反应性:尽管化合物32可能具有良好的化学稳定性,但其复杂的电荷分布和多变的原子属性使其在某些化学反应中表现出高反应性。
06.化合物32的激酶选择性谱
评估化合物32对一系列激酶的抑制活性,以衡量其作为DYRK1A抑制剂的选择性。
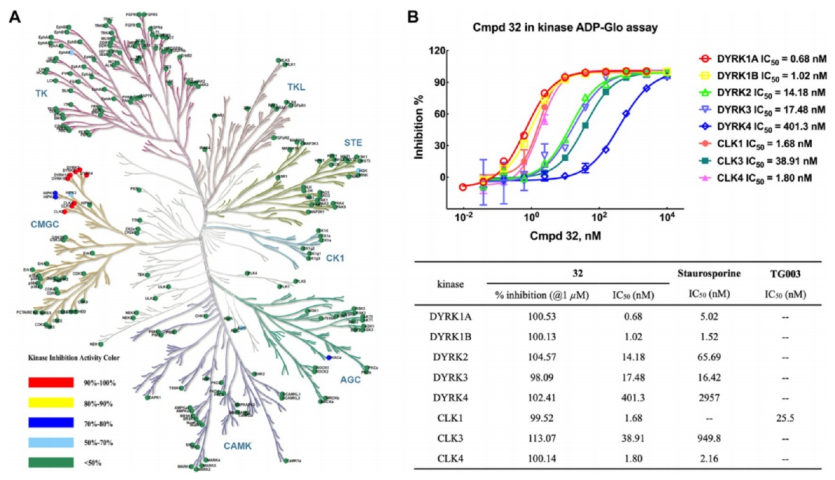
激酶抑制筛选:化合物32在1微摩尔浓度下对大多数蛋白激酶的抑制活性低于30%,特别是对DYRK1B、DYRK2、DYRK3、DYRK4、CLK1、CLK3和CLK4的抑制活性较低,均低于10%。
ADP-Glo分析:ADP-Glo分析进一步证实了化合物32对其他DYRK和CLK激酶的抑制效果,尤其是对CLK1和CLK4的抑制作用较弱。
选择性分析:尽管化合物32对多种激酶显示出抑制作用,但其对DYRK1B的抑制作用最为显著,IC50值为1.02纳摩尔,而对其他DYRK同型酶的抑制作用相对较弱。
其他激酶的抑制:化合物32对CDK9和GSK-3β也表现出中等程度的抑制活性,但对GSK-3β的抑制更为强烈,这表明化合物32可能对治疗阿尔茨海默病有益。
潜在的非靶向风险:尽管化合物32显示出良好的选择性,但仍需注意其对CLK1和CLK4的潜在抑制作用,这可能会影响其在治疗中的应用。
07.化合物32的细胞功效评估
评估了化合物32在细胞层面的效力,特别是其对tau蛋白磷酸化的影响。
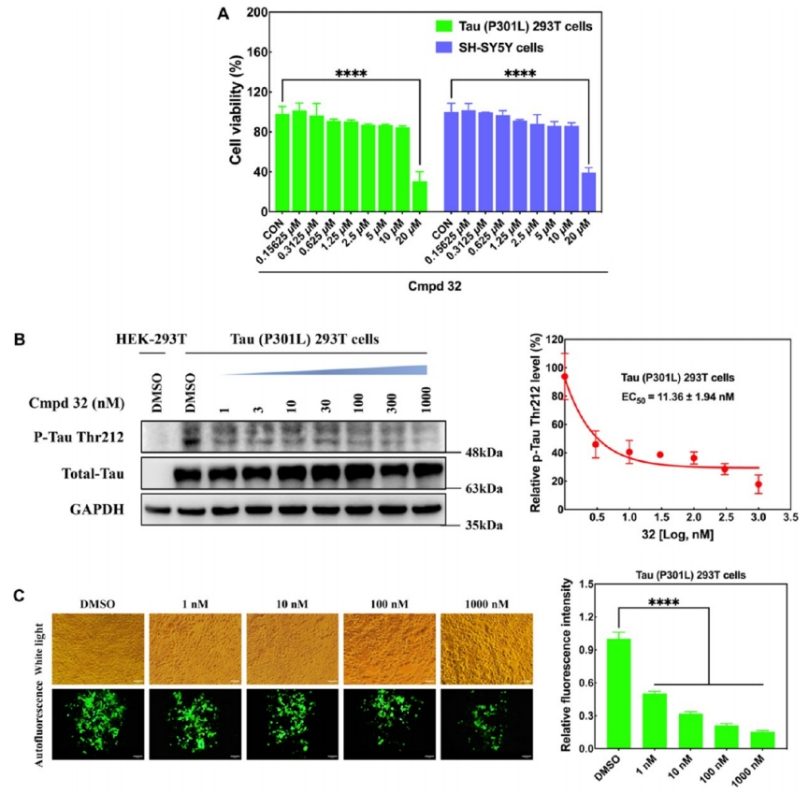
细胞毒性测试:首先,研究者通过MTT实验评估了不同浓度下化合物32对Tau (P301L) 293T和SH-SY5Y细胞的毒性效应,发现低浓度的化合物32对这些细胞几乎没有毒性,而高浓度则显示出显著的细胞毒性。
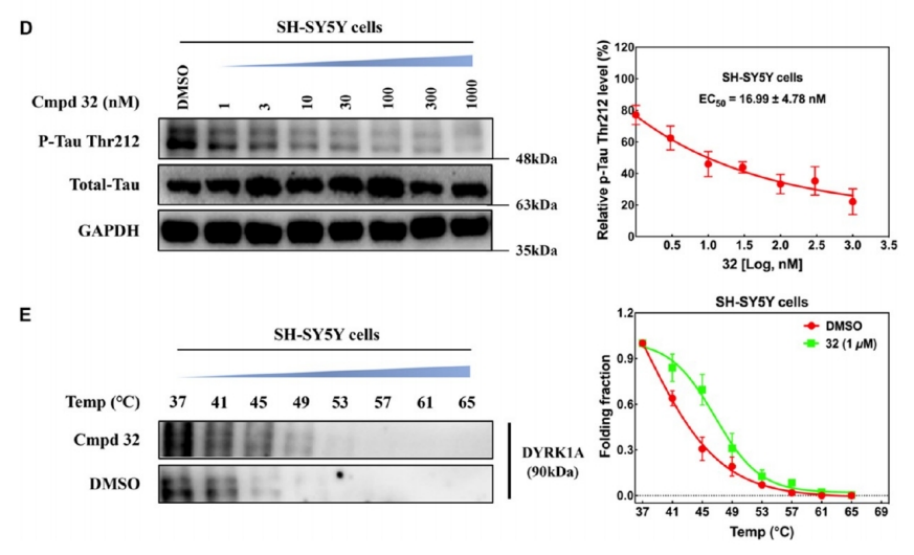
tau磷酸化抑制:接着,通过Western blot分析,研究者发现化合物32能够显著降低Tau (P301L) 293T细胞中DYRK1A介导的tau磷酸化,其EC50值为11.36纳摩尔。
荧光成像分析:荧光成像分析进一步证实了化合物32能够显著减少突变P301L-hTau单体蛋白的表达,这种神经毒性是tau蛋白过度磷酸化的标志。
细胞热移位实验:在SH-SY5Y细胞中,细胞热移位实验(CETSA)显示化合物32能够提高DYRK1A的蛋白稳定性,表明化合物32能够直接作用于细胞内的DYRK1A并发挥其效果。
08.化合物32的体内药代动力学特征及血脑屏障通透性
评估了化合物32在体内的药代动力学特性以及其穿透血脑屏障(BBB)的能力。
静脉注射药代动力学:静脉注射2 mg/kg的化合物32后,其血药浓度随时间变化的曲线显示,化合物32具有适中的曲线下面积(AUC0-t)和表观分布容积(Vd),以及可接受的半衰期(T1/2)和平均驻留时间(MRT)。
口服生物利用度:口服10 mg/kg的化合物32后,显示出良好的口服生物利用度(F = 39.7%),表明该化合物可以通过口服途径有效吸收进入体内。
血脑屏障渗透率:通过测量脑组织和血浆中的化合物浓度比值(Kp(brain/plasma)),发现化合物32在脑组织中的浓度随时间逐渐增加,最大值出现在4小时后,表明化合物32具有一定的血脑屏障渗透能力。
急性毒性实验:急性毒性实验表明,单次口服500 mg/kg的化合物32对C57BL/6小鼠没有致死效应,且主要器官的重量与对照组无显著差异,显示出良好的安全性。
09.化合物32的急性毒性研究
进行了化合物32的急性毒性研究,以评估其安全性。
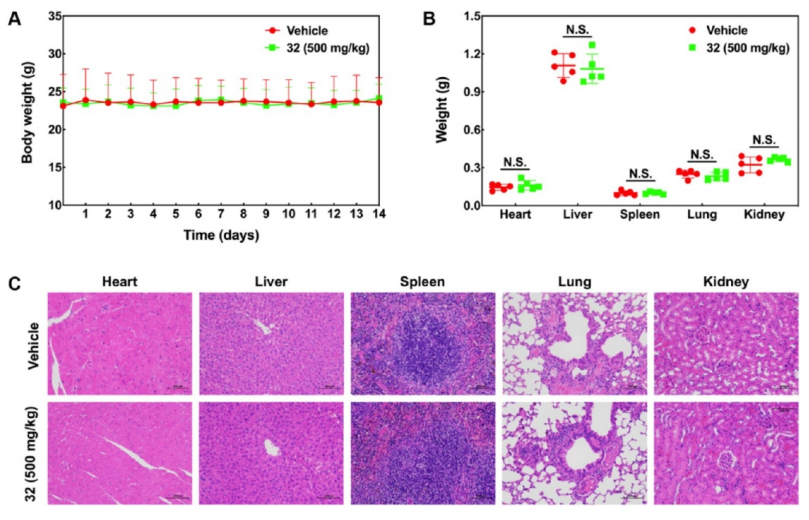
体重监测:实验期间,监测了小鼠的体重变化,结果显示治疗组与对照组的体重差异不显著,表明化合物32对小鼠的体重没有显著影响。
器官重量分析:处死后,称量了小鼠的主要器官(心、肝、脾、肺、肾)重量,发现治疗组与对照组的器官重量差异也不显著,进一步证明了化合物32的安全性。
组织病理学检查:通过H&E染色分析,观察了小鼠主要器官的组织病理学变化,未发现显著病理改变,说明化合物32对这些器官没有明显的毒性作用。
10.化合物32在OA诱导的AD小鼠模型中的体内功效评估
探讨了化合物32在体内对由Okadaic acid (OA)诱导的阿尔茨海默病(AD)小鼠模型的疗效。
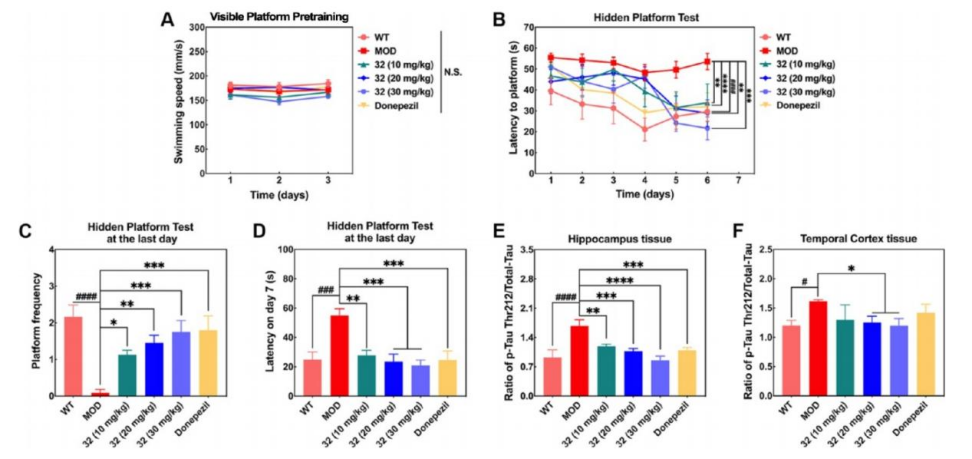
行为学测试:Morris水迷宫测试显示,与对照组相比,OA诱导的小鼠逃避潜伏期显著延长,而化合物32治疗组能够显著缩短逃避潜伏期,改善学习记忆功能。
tau蛋白磷酸化:ELISA结果表明,OA诱导能够上调小鼠海马体和颞叶皮层中的p-Tau Thr212水平,而化合物32治疗能够显著降低这些区域的p-Tau Thr212水平。
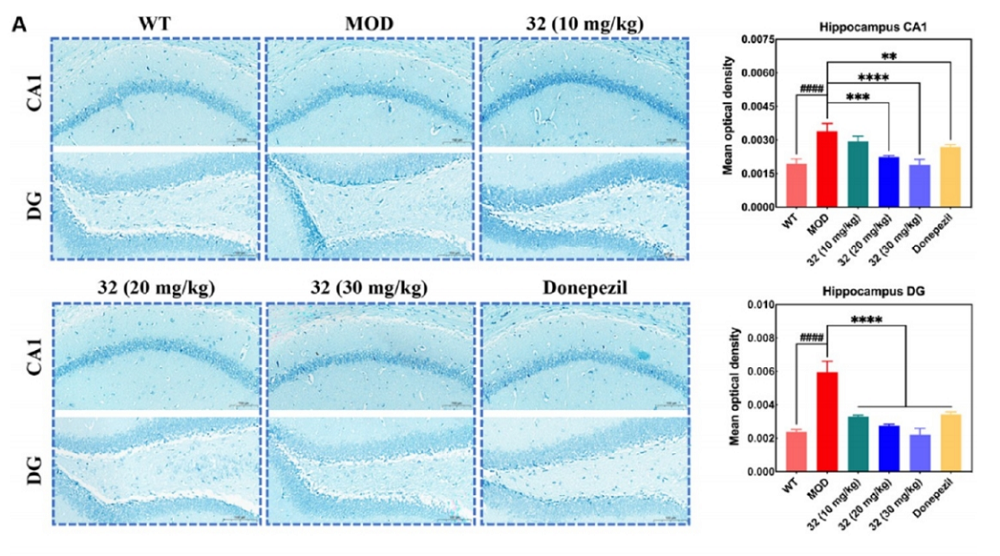

神经元损伤:Nissl染色和免疫组化染色结果显示,OA诱导的小鼠海马CA1和DG区域的神经元损伤明显,而化合物32治疗能够显著减轻这种损伤。
血清生化指标:治疗后,小鼠的血清生化指标(如AST、ALT、AKP、TBIL、GSH、BUN和CRE)未见明显异常,表明化合物32的安全性。
本研究通过经典的药物化学程序,成功鉴定出一种名为化合物32(ZJCK-6-46)的新型DYRK1A抑制剂。该化合物对DYRK1A具有极高的抑制活性,IC50值仅为0.68 nM,并且具有良好的激酶选择性、代谢稳定性、穿透血脑屏障的能力和细胞渗透性。在细胞实验中,化合物32能显著降低tau蛋白的磷酸化,且在动物模型中展现出改善认知障碍的潜力,同时具有较低的急性毒性和肝肾损伤风险。尽管如此,化合物32仍存在一些问题,如对CLKs的抑制作用和可能的P-糖蛋白外排问题,这些问题需要进一步研究以优化其作为抗阿尔茨海默病药物的应用。此外,探索化合物32的其他生物学功能在治疗AD中的应用也是一个研究方向。