Cbl-b蛋白是一类 E3 泛素蛋白连接酶,负向调节免疫功能,极有希望成为一种新型细胞内免疫检查点药物靶点。
青云瑞晶已完成Cbl-b靶点蛋白的表达和结构解析。基于这些实验条件和库存蛋白,青云瑞晶将项目的交付时间缩短至1-2个月,并确保项目的成功交付。
Cbl-b全名Casitas B lymphoma-b(Uniprot ID Q13191),是一种RING-type E3泛素蛋白连接酶,属于CBL家族的成员,在人类中由CBLB基因编码。E3 泛素蛋白连接酶,从特定的E2泛素结合酶中接受泛素,并将其转移到底物上,从而促进蛋白酶体对底物的降解。
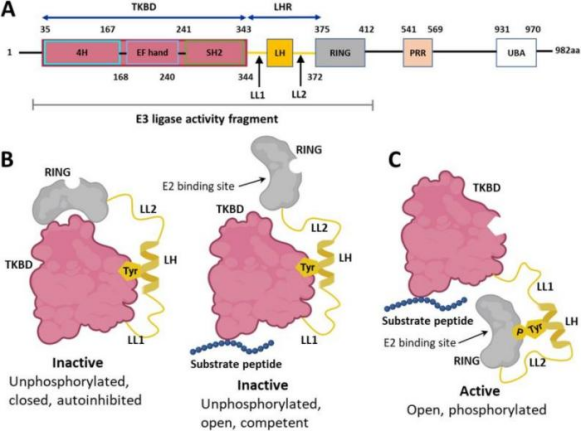
Cbl-b蛋白全长982个氨基酸,由不同的结构域组成,包含高度保守的磷酸酪氨酸激酶结合结构域(TKB)、连接结构域(LH)、环指结构域(RING)和C端的富脯氨酸结构域(PRR)、泛素结合结构域(UBA)。其中TKB结构域包含四螺旋束(4H)序列、Ca2+结合EF-hand序列、SH2序列共三个亚结构域,并通过连接子(LHR)与RING锌指结构域相连,TKB、LHR、RING三个结构域共同行使E3连接酶催化活性并通过其TKB结构域靶向磷酸化酪氨酸激酶(包括生长因子受体和细胞因子受体)以及非受体酪氨酸激酶。
Cbl-b不同构域之间构象变化会导致蛋白呈现封闭的非活性(inactive)构象或者开放的活性(active)构象。LH被夹在TKB结构域上,限制了RING结构域的运动,使其要么处于封闭和自动抑制状态,要么处于开放状态并能与E2结合。保守的酪氨酸(Tyr363,标记为Tyr)被磷酸化后(PTyr),LH从TKB中释放,RING结构域翻转180度,移至底物附近,Cbl-b从自抑制的封闭状态转变为有活性的开放状态。针对Cbl-b靶点设计的抑制剂小分子一般结合在非活性构象的TKB结构域和LHR结构域之间,将蛋白稳定在非活性封闭构象,类似于SHP2变构抑制剂的机理。
Cbl-b可负向调节TCR(T细胞受体)、BCR(B细胞受体)和FCER1(高亲和力免疫球蛋白ε受体)信号转导途径;同时,在受体酪氨酸激酶(RTKs)的内吞和溶酶体降解等负向调控过程中,c-Cbl和Cbl-b蛋白作为泛素连接酶和内吞接头分子也发挥了关键作用。Cbl-b在T细胞中的表达会导致配体诱导的T细胞受体下调,从而控制T细胞在抗原递呈过程中的活化程度。因此泛素连接酶Cbl-b在细胞中高表达可降低免疫细胞对靶细胞的识别和杀伤活性。Cbl-b在一些肿瘤细胞中高表达,比如黑素瘤组织、胃癌组织,高表达的Cbl-b能够帮助这些肿瘤细胞免疫逃逸,且与胃癌的侵袭及淋巴结转移相关。因此抑制Cbl-b活性可增强抗肿瘤免疫效应,如同另一免疫靶点PD-1一样。
癌症免疫疗法(Cancer immunotherapy,CI)是依靠激活患者自身的免疫细胞来对抗肿瘤,在过去十年中彻底改变了肿瘤治疗模式。然而,即使在肺癌领域,许多最成功的免疫检查点阻断疗法已获得批准,但只有一部分(25-30%)患者对此类药物有反应并从中获益。因此,迫切需要更多的CI药物来帮助更多的癌症患者。Cbl-b作为一种重要的免疫调控靶点,在肿瘤的免疫治疗领域越来越多的成为抗肿瘤药物的设计靶点,展现出了越来越大的前景。
因此解析Cbl-b不同活性状态的结构对于开发相关靶点药物具有重要意义。
青云瑞晶针对Cbl-b蛋白完成了38-427(包含TKB、LHR、RING三个结构域)片段的表达、纯化和结晶,针对该靶点及其抑制剂的共晶结构也累积了丰富的数据。同时储备了Cbl-b通路上下游相关靶点蛋白的表达、纯化和结晶经验,可将项目项目的交付时间缩短至1-2个月,并确保项目的成功交付,满足企业药物研发需求。


表达纯化结果(周期:现货/定制约1周)

结晶和结构解析(周期:2-4 周)