细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)又名CD152,是一种白细胞分化抗原。CTLA-4作为一类免疫检查点,参与免疫反应的负调节,对移植排斥反应及各种自身免疫性疾病有显著的治疗作用,可开发为单抗类药物在晚期实体肿瘤治疗中发挥重要作用。
青云瑞晶已完成CTLA4靶点的蛋白表达和结构解析。基于这些实验条件和库存蛋白,青云瑞晶将项目的交付时间缩短至1-2个月,并确保项目的成功交付。


蛋白纯化结果(周期:现货或者3周)
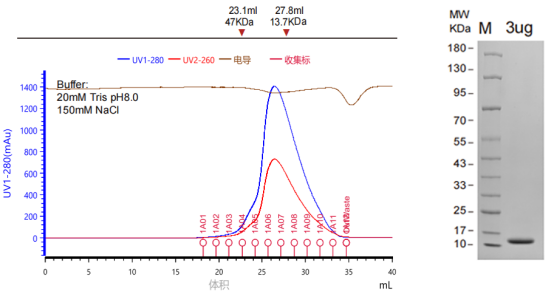
结晶和结构解析(周期:1-2周)

01.CTLA4简介
细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)又名CD152,是一种白细胞分化抗原,是T细胞上的一种跨膜受体,与CD28共同享有B7分子配体,而CTLA-4与B7分子结合后诱导T细胞无反应性,参与免疫反应的负调节。基因重组的CTLA-4 Ig可在体内外有效、特异地抑制细胞和体液免疫反应,对移植排斥反应及各种自身免疫性疾病有显著的治疗作用,毒副作用极低,是目前被认为较有希望的新的免疫抑制药物。
02.CTLA4发现历史
1987年,Pierre Golstein及其同事鉴定了细胞毒性T淋巴细胞抗原4或CTLA-4。1995年11月,Tak Wah Mak和Arlene H. Sharpe的实验室通过敲除小鼠基因,独立发表了关于CTLA-4作为T细胞活化负调节因子的功能的发现。几个实验室以前的研究使用的方法无法明确定义CTLA-4的功能,并且是相互矛盾的。
03.CTLA4的功能
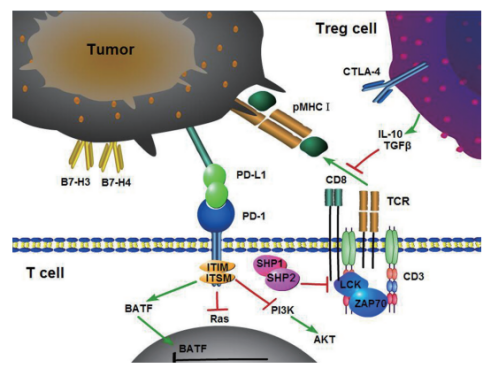
CTLA4是免疫球蛋白超家族的成员,其由活化的T细胞表达并将抑制信号传递给T细胞。CTLA4与T细胞共刺激蛋白CD28同源,并且两种分子在抗原呈递细胞上分别与CD80和CD86(也称为B7-1和B7-2)结合。CTLA-4以比CD28更大的亲和力和亲合力结合CD80和CD86,因此使其能够胜过CD28的配体。CTLA4向T细胞传递抑制信号,而CD28传递刺激信号。CTLA4也在调节性T细胞(Tregs)中发现并有助于它们的抑制功能。通过T细胞受体和CD28的T细胞活化导致CTLA-4的表达增加。
CTLA-4在T细胞中起作用的机制仍然存在争议。生化证据表明,CTLA-4为T细胞受体(TCR)募集磷酸酶,从而减弱信号。自第一次出版以来,这项工作在文献中仍未得到证实。最近的研究表明,CTLA-4可以通过从抗原呈递细胞的膜中捕获和去除B7-1和B7-2而在体内起作用,从而使得它们不能用于触发CD28。
除此之外,已发现树突状细胞(DC) - Treg相互作用导致Fascin-1的隔离,Fascin-1是免疫突触形成所必需的肌动蛋白成束蛋白,并且将抗原呈递DC中的Fascin-1依赖性肌动蛋白极化倾向于Treg细胞粘附区。虽然它在T调节细胞脱离后是可逆的,但是这种必需的细胞骨架成分的隔离导致DC的昏睡状态,导致T细胞引发减少。这表明Treg介导的免疫抑制是一个多步骤的过程。除CTLA-4 CD80 / CD86相互作用外,细胞骨架对DC-Treg免疫突触的肌成束蛋白依赖性极化可能起关键作用。
CTLA-4也可通过PI3激酶调节细胞运动和/或信号传导发挥作用早期多光子显微镜研究观察完整淋巴结中的T细胞运动似乎证明了所谓的“反向停止信号模型” 。在该模型中,CTLA-4逆转了T细胞与抗原呈递细胞(APC)之间牢固接触所需的TCR诱导的“终止信号”。然而,这些研究比较了CTLA-4阳性细胞,其主要是调节细胞并且至少部分激活,具有CTLA-4阴性幼稚T细胞。这些细胞在多个方面的差异可以解释这些结果中的一些。已经分析了体内抗体对CTLA-4的影响的其他群体对无反应性T细胞的运动性几乎没有或没有影响。抗体到CTLA-4在体内使用时,通过结合并由此消耗的调节性T细胞可发挥附加的效果。
04.CTLA4临床意义
CTLA-4基因的变异与1型糖尿病,格雷夫斯病,桥本氏甲状腺炎,乳糜泻,系统性红斑狼疮,甲状腺相关性眼眶病,原发性胆汁性肝硬化和其他自身免疫性疾病有关。
CTLA4的种系单倍体不足导致CTLA4缺乏或CHAI疾病(CTLA4单倍体不足与自身免疫浸润),这是一种罕见的免疫系统遗传疾病。这可能导致免疫系统失调,并可能导致淋巴细胞增殖,自身免疫,低丙种球蛋白血症,反复感染,并可能略微增加淋巴瘤的风险。
临床和实验室表现:
具有CTLA4突变的症状性患者的特征在于免疫失调综合征,包括在许多器官中广泛的T细胞浸润,包括肠,肺,骨髓,中枢神经系统和肾。大多数患者有腹泻或肠病。淋巴结病和肝脾肿大也很常见,自身免疫也是如此。受自身免疫影响的器官各不相同,但包括血小板减少症,溶血性贫血,甲状腺炎,I型糖尿病,牛皮癣和关节炎。呼吸道感染也很常见。重要的是,临床表现和疾病过程是变化的,一些人受到严重影响,而其他人几乎没有表现出疾病。这种“可变表现力”,即使在同一家族中,也可能引人注目,可以通过生活方式,暴露于病原体,治疗效果或其他遗传修饰因素的差异来解释。这种情况被描述为具有不完全的疾病外显率。
临床症状是由免疫系统异常引起的。大多数患者发生至少一种免疫球蛋白同种型水平降低,并且在T调节细胞中具有低CTLA4蛋白表达,效应T细胞的过度活化,低转换记忆B细胞和循环B细胞的进行性丧失。
05.CTLA4单抗复合物结构
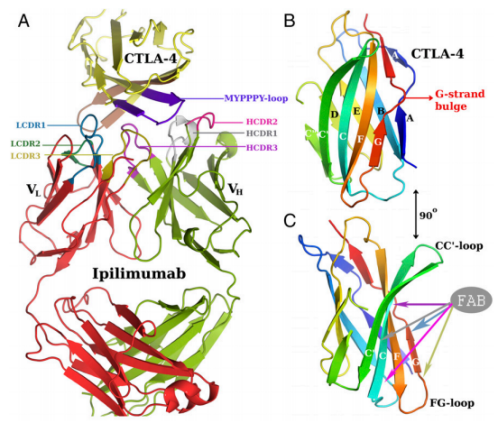
(A)凹形的CTLA-4正面,由CC′(米色)和FG(MYPPPY环;深紫色)链组成,埋在ipilimumab单抗的CDRs之间。CDRs、FG和CC′链被着色:LCDR3(橄榄色)和LCDR1(蓝绿色)与G链存在氢键作用。HCDR2(粉红色)和HCDR1(浅灰色)共同对结合F和C链,并参与氢键和疏水相互作用。HCDR3(洋红色)插入到CTLA-4的前面表面的中心,并只参与疏水相互作用。(B)彩色表示(CTLA-4分子的N到C端从蓝色过渡到红色),前面和背面链分别标记为白色和黑色。抗原受体之间保守的β链凸起显示为红色。(C) CTLA-4相对于B绕纵轴旋转90°,突出了前凹(PDB:5TRU)。
06.CTLA4蛋白行业研发状况
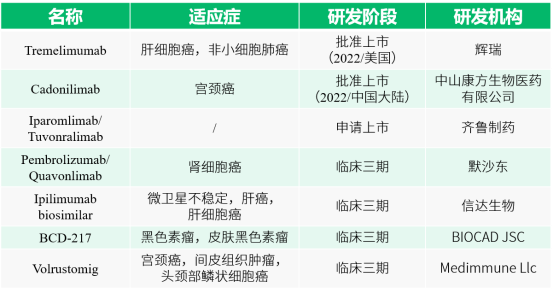
参考文献:
[1]ZUO Qiao-Zhu, QIN Wen-Xin. (2017). Progress of CTLA-4 and PD-1 signaling pathways in immunotherapy for human solid cancers. Chinese Bulletin of Life Sciences, 1004-0374(2017)08-0713-09. DOI:10.13376/j.cbls/2017096
[2]Ramagopala, U. A., Liu, W., Garrett-Thomson, S. C., Bonanno, J. B., Yan, Q., Srinivasan, M., Wong, S. C., Bell, A., Mankikar, S., Rangar, V. S., Deshpande, S., Korman, A. J., & Almo, S. C. (2017). Structural basis for cancer immunotherapy by the first-in-class checkpoint inhibitor ipilimumab. Proceedings of the National Academy of Sciences, 114(19), E3366-E3375.