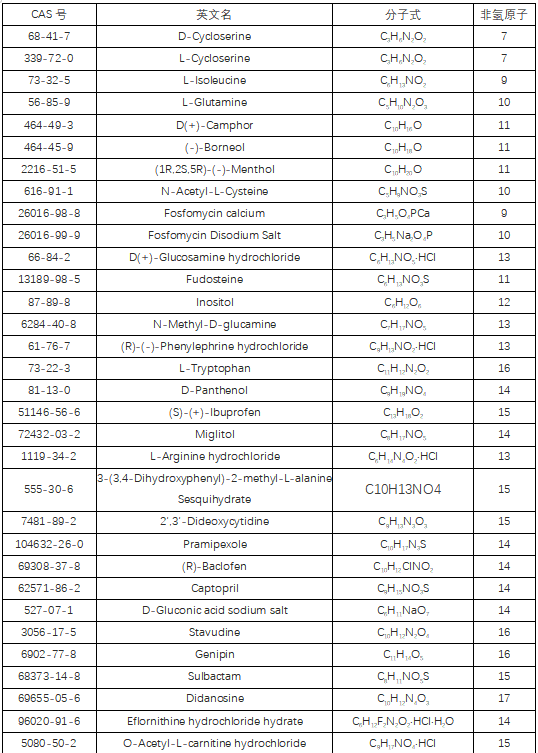
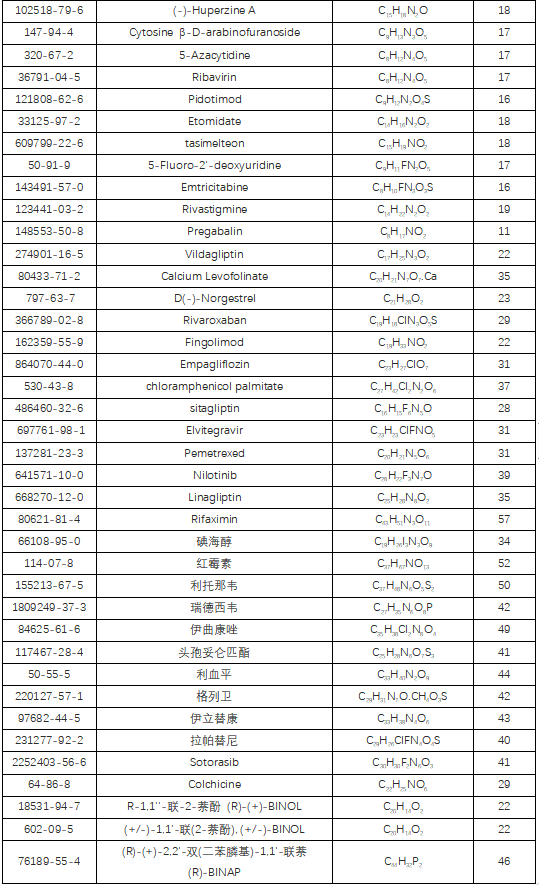
手性药物(Chiral Drug),是指药物分子结构中引入手性中心后,得到的一对互为实物与镜像的对映异构体。每一对化学纯的对映异构体的理化性质有所不同(不仅仅体现在旋光性上),根据不同的命名法则可以被命名为R-型或S-型、D-型或L-型、P-型或M-型、左旋或右旋。
目前,临床上所用的药物50%是手性药物,全球销量前十的药物中有9个是手性药物。手性药物占比如此之大的原因是构成药物靶标的基本单元——氨基酸、核苷酸等都是手性结构。
手性(Chirality)是分子构型的一个重要因素。有机化合物在立体化学中被区分为各种类型的异构体,如构象异构、几何异构、旋光异构(对映异构)等。旋光异构形成的关键就在于分子具有不对称性(手性)。手性分子是不能与自己的镜像分子重合的有机化合物。
手性分子主要有三类:
1含手性原子的手性分子;
2轴手性化合物(含手性轴的旋光异构体);
3含手性面的旋光异构体。
R/S标记法:
R/S系统是表示对映体的重要命名系统。该方法基于原子序数的优先级规则,根据系统为每个手性中心R或S分配一个优先级,通过该系统为其每个取代基分配一个优先级。当中心的方向使四个取代基中优先级最低的远离观察者时,观察者将看到两种可能性:如果其余三个取代基的优先级沿顺时针方向降低,则标记为R(Rectus , 拉丁语,意为右旋); 如果逆时针方向降低,则为S(Sinister,拉丁语,意为左旋)。( R ) 或 ( S ) 以斜体和括号书写。如果有多个手性碳,例如 (1 R ,4 S ),则数字指定每个构型之前的碳位置。
R/S标记法的判断法则:
a. 按次序规则给手性碳相连的各基团排列大小;
b. 将最小的基团放在离眼睛最远的地方;
c. 其它三个基团按由大到小的方向旋转,旋转方向是顺时针的,手性碳为R构型,旋转方向是逆时针的,手性碳为S构型。
d. 当碰到多原子基团比较时,先从第一个原子比起,原子序数大的在前。若第一个原子相同,再比较与第一个原子相连的其它原子,先从最大的比起,若仍相同,再比较居中的,最小的,直至比较出谁先大。
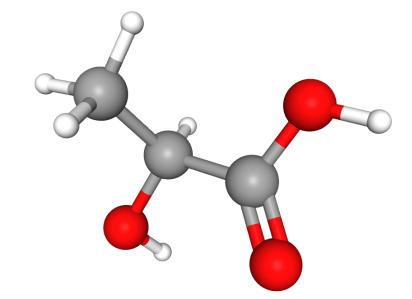
如图一所示,按照R/S标记法的判断法则,手性中心与-H、-CH3、-OH和-COOH四个基团相连,相连的第一个原子分别是H、O、C、C,其中O原子序数最大,排第1,H原子序数最小,排第4,剩下两个都是碳,没法比较大小,所以要接着往下比,-CH3的碳往下连接的三个原子从大往小排分别为H、H、H,-COOH的碳往下连接的两个原子从大往小排分别为O、H,我们要先从最大的原子比起,那么也就是用-CH3的H与-COOH的O相比,O比H原子序数大,-COOH比-CH3次序高。所以-COOH和-CH3次序分别为2和3。
于是,将最小的基团放在离眼睛最远的地方,我们可以看出其它三个基团按由大到小的方向旋转,旋转方向是逆时针的,手性碳为S构型。
D/L标记法:
光学异构体可以根据其原子的空间构型命名。D/L系统(以拉丁文 dexter 和 laevus 命名,右和左), 通过将分子与甘油醛相关联来实现。甘油醛本身是手性的,它的两个异构体标记为D和L。在这个系统中,化合物的命名类似于甘油醛,通常会产生明确的名称,D/L标记表示化合物相对于甘油醛的右旋或左旋对映体的立体结构。甘油醛的右旋异构体实际上是D-异构体。蛋白质中常见的十九种L-氨基酸中有九种是右旋的(波长为 589 nm),而D-果糖也被称为左旋糖,因为它是左旋的。确定氨基酸D/L异构形式的经验法则是“CORN”法则。
D/L标记法的判断法则:
a. -COOH、-R、-NH2和-H(其中 R 是侧链)排列在手性中心碳原子周围;
b. 氢原子远离观察者,若CO → R → N基团围绕碳原子为中心逆时针排列,则为L型。如果顺时针排列,就是D型。
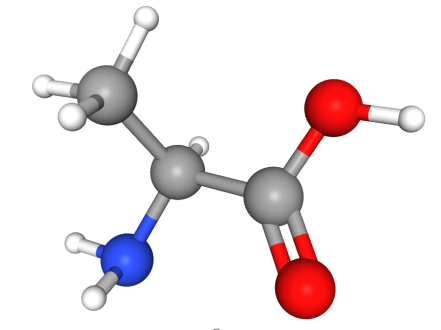
如图二所示,按照D/L标记法的判断法则,手性中心与-H、-COOH、-R和-NH2四个基团相连,将最小的基团(-H)放在离眼睛最远的地方,我们可以看出其它三个基团按CO → R → N基团围绕碳原子旋转,旋转方向是逆时针的,手性碳为L构型。
P/M标记法:
对于含有手性轴的化合物,缺乏使用RS标记法对应的手性中心。我们看到手性轴可以与螺旋相联系,这些分子可以被看作是螺旋状的,也可以看作是螺旋桨或螺旋形结构,通常使用P/M标记法来标记其构型。
P/M标记法的判断法则:
a. 从手性轴的任意端向内看,沿着手性轴把化合物分隔成近组和远组;
b. 确定最高优先级的近组和最高优先级的远组;
c. 如果从最高优先级的近组移动到相应的远组需要顺时针旋转,螺旋是一个右手螺旋,被描述为P(或正)。逆时针旋转意味着左手螺旋,并指定为M(或负)。
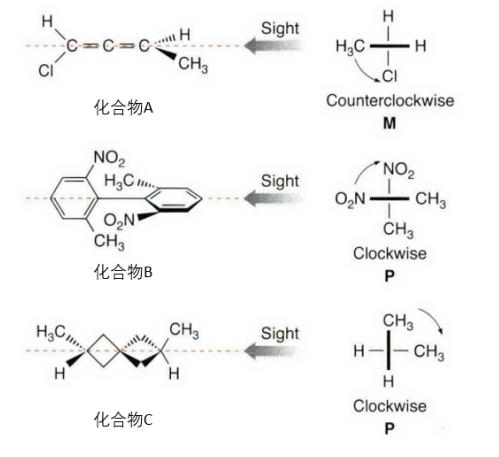
如图三所示,按照P/M标记法的判断法则,化合物A的近组最高优先级为C原子,远组最高优先级为Cl原子,按C → Cl的方向旋转,旋转方向是逆时针的,手性化合物为M构型;化合物B的近组最高优先级为N原子,远组最高优先级也为N原子,按N→ N的方向旋转,旋转方向是顺时针的,手性化合物为P构型;化合物C的近组最高优先级为C原子,远组最高优先级也为C原子,按C → C的方向旋转,旋转方向是顺时针的,手性化合物为P构型。
单晶X射线衍射通过反常散射确定分子结构的绝对构型。当原子上的电子被看成自由电子时,对X射线的散射因子为f0,散射波与入射波的相角差为固定值(π)。然而,不同原子对电子的束缚能力有所不同,导致核外电子的散射能力与自由电子的散射能力有所不同,散射相角也发生一定的漂移。这种现象与X射线的波长有关,称为反常散射(Anomalous Scattering)。
而微晶电子衍射(MicroED)是通过动力学精修的方式确定分子结构的绝对构型。相比X射线,电子波长短,与物质的相互作用比 X 射线强数万倍,可以用来研究 X 射线衍射无法达到的纳米级别的晶体材料。即使在极微小区域也可以获得较强的电子衍射,特别适合微区、纳米区域晶相的分析和鉴别。同时电子衍射的这个优势也带来一个问题,使得在TEM下收集到的衍射图案具有更强的动力学效应,动力学效应是结构解析的绊脚石,如图四所示。
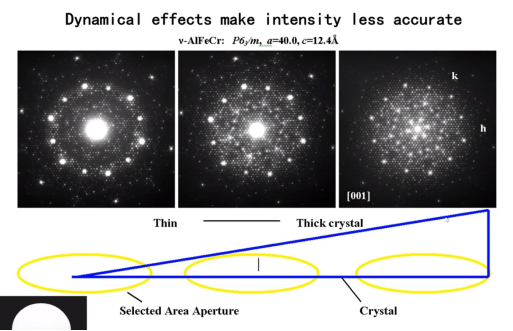
对于手性结构,相同化合物在相反手性下产生的动力学效应存在显著差异。在解析出手性化合物相对构型的情况下,可以反过来利用两者在动力学效应的差异,通过动力学精修确认手性化合物的绝对构型。
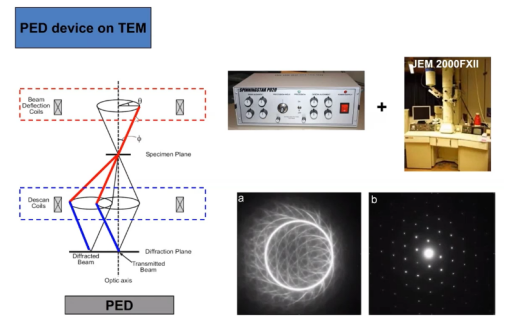
1. 首先,我们在收集数据时会加入旋进(PED,Precession Electron Diffraction),PED可以平均化动力学效应对于衍射图案的影响,如图五所示;
2. 接下来,由于晶体的thickness, mosaicity, bending, defects等是影响动力学效应十分重要的因素,在数据处理时需要通过衍射点强度积分的双驼峰图选定用于动力学精修的衍射数据;
3. 最后,使用选定的衍射数据分别精修不同手性的化合物,从二者的差异很容易确定未知手性化合物的绝对构型,图六展示了已成功通过动力学精修方式确定绝对构型的75个案例。