前言
微管是真核细胞骨架的关键组成部分,对细胞分裂、细胞内物质运输及细胞形态维持至关重要。
微管蛋白由 αβ-微管蛋白异二聚体构成,其组装与解聚过程依赖于一类称为 微管蛋白结合辅助因子(TBCs)的伴侣蛋白,包括 TBCA、TBCB、TBCC、TBCD、TBCE;此外,小GTP酶Arl2也参与调控该过程。
尽管这一过程对于维持细胞骨架稳态至关重要,其原子水平的结构机制长期以来尚不明确。
2025年10月30日,首尔国立大学Soung-Hun Roh团队通过冷冻电镜解析了六种微管蛋白结合辅助因子(TBCs)的高分辨率结构(2.1-2.5 Å),首次从结构层面揭示了TBCs与Arl2作为分子开关与GTP酶调控中心,共同介导αβ-微管蛋白异源二聚体“解聚-组装”双向调控的分子机制。
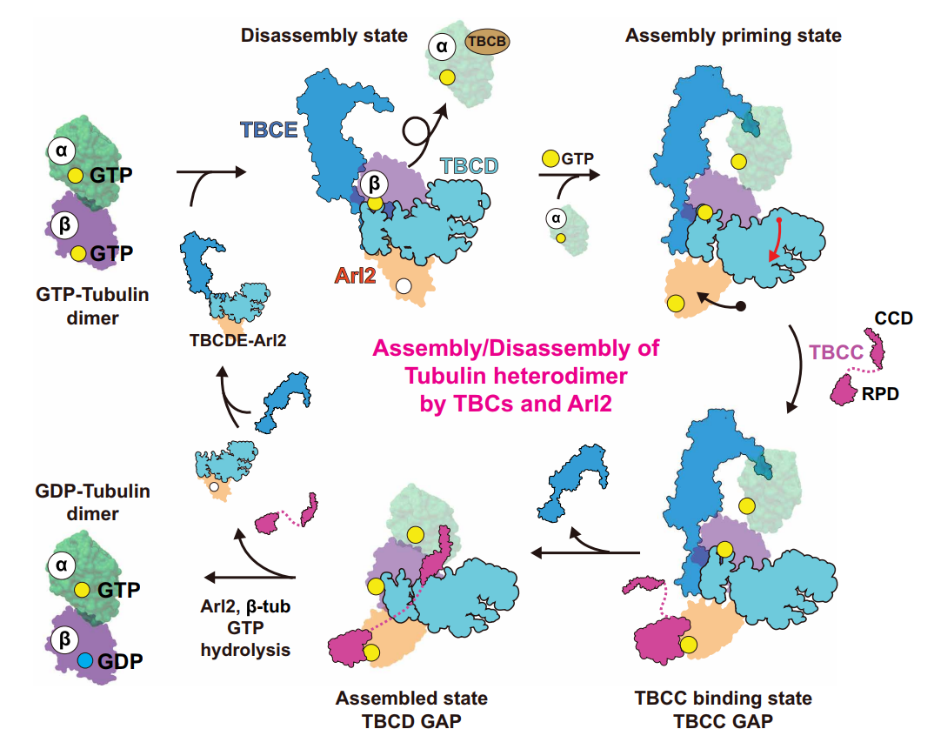
αβ-微管蛋白异二聚体组装-拆卸循环示意图
该研究以“Structural dissection of αβ-tubulin heterodimer assembly and disassembly by human tubulin-specific chaperones”为题发表在《Science》上。

研究内容
1. 复合物重构与结构解析
研究团队从哺乳动物细胞中纯化了人源TBCDE–Arl2复合物及TBCC,并在大肠杆菌中表达TBCA和TBCB。在特定GTP条件下,将上述组分与αβ-微管蛋白重组,成功获得六个结构状态的高分辨率冷冻电镜结构(分辨率为2.1–2.5 Å)。
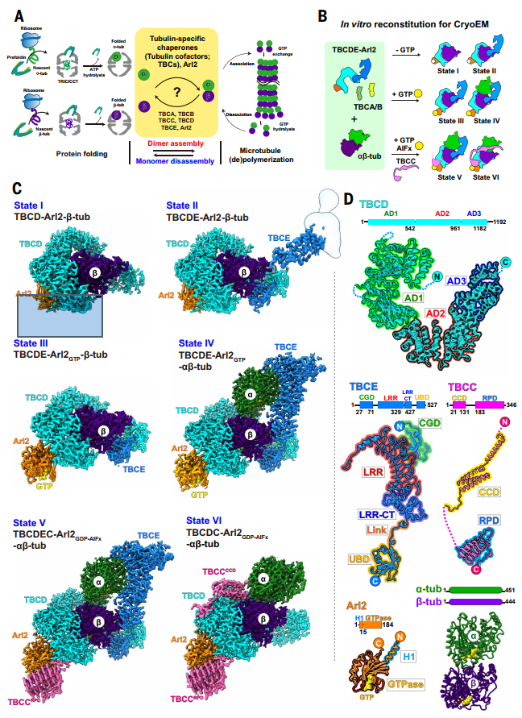
图1. TBC-微管蛋白复合物的6种结构状态重构
2. 六种结构状态(State I–VI)
无GTP的解聚状态
在无GTP条件下,复合物处于State I(TBCD–Arl2–β-微管蛋白)和State II(TBCDE–Arl2–β-微管蛋白)。此时α-微管蛋白完全解离,仅β-微管蛋白被解析,其通过静电互补作用被稳定。
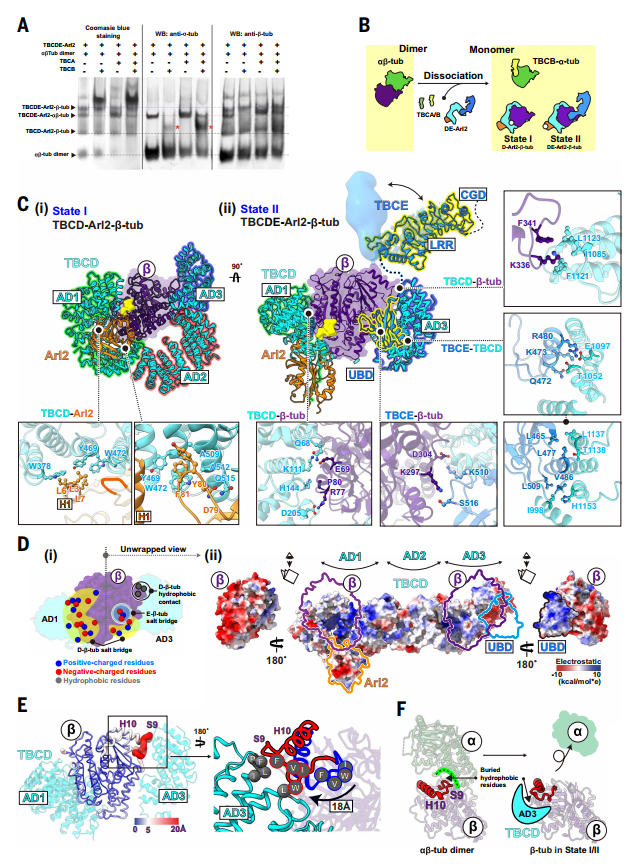
图2. TBC复合物分解微管蛋白异二聚体并稳定β-微管蛋白单体
GTP触发组装启动
加入GTP 后,Arl2 在State III(TBCDE-Arl2GTP-β-微管蛋白)中发生显著构象变化,使TBCD 的AD2 结构域位移,解除对α-微管蛋白结合的空间位阻,进而形成State IV(TBCDE-Arl2GTP-αβ-微管蛋白)。此时 α-微管蛋白可被解析,表明异二聚体进入部分组装状态。
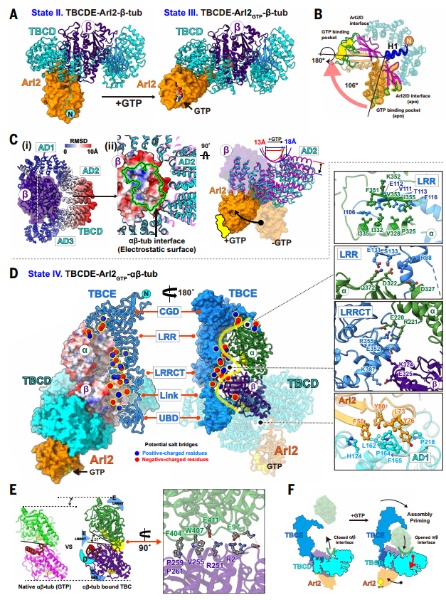
图3. GTP诱导的TBCs构象变化启动αβ-微管蛋白异源二聚体组装
异源二聚体组装完成
研究进一步利用GTP-AlFx模拟GTP水解后状态,发现TBCC通过两个结构域分步发挥作用:在State V中,其调控结构域(RPD)结合Arl2的GTP结合位点,辅助其GTP酶活性;在State VI中,TBCC的卷曲螺旋结构域(CCD)作为“分子夹子”桥连α/β-微管蛋白,同时促使TBCE解离,使异源二聚体形成天然界面,完成组装。
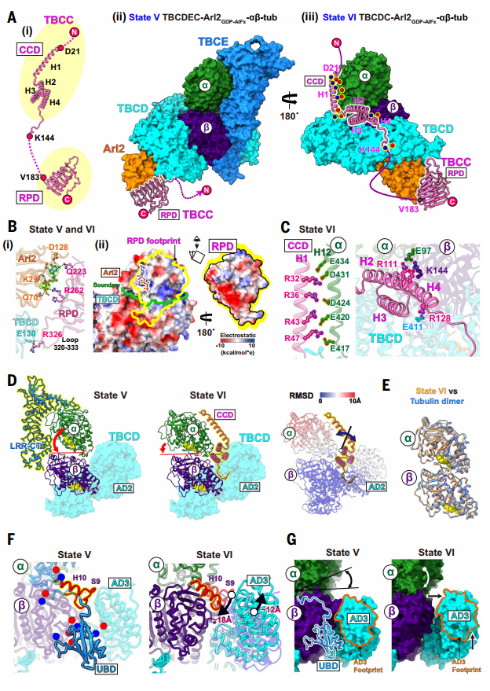
图4. TBCC 介导异二聚体组装完成
3. TBCD:β-微管蛋白的GAP
结构分析还揭示了TBCD作为β-微管蛋白的GTP酶激活蛋白(GAP)的关键功能。β-微管蛋白的GTP水解与Arl2的GTP酶活性相耦合,形成“双重质控检查点”,确保仅释放完全组装成熟的异二聚体。
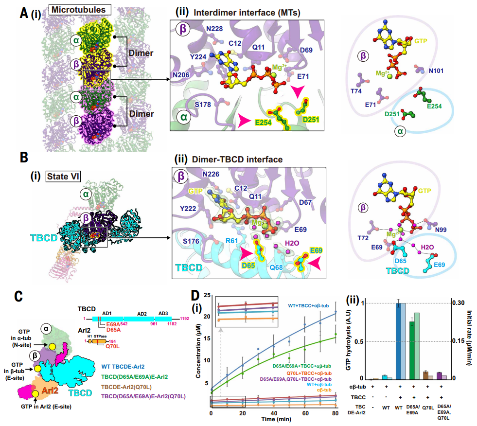
图5. TBCD作为β-微管蛋白的GAP发挥作用
总结
本研究通过高分辨率冷冻电镜结构解析,首次系统揭示了TBCs与Arl2在αβ-微管蛋白异二聚体组装与解聚过程中的分子机制:Arl2通过其GTP结合状态作为分子开关,驱动TBCs发生构象变化,从而实现“无GTP时解聚、有GTP时组装”的动态调控;Arl2与β-微管蛋白的协同GTP水解活性构成了严格的质量控制机制,确保微管蛋白稳态的精确调节。
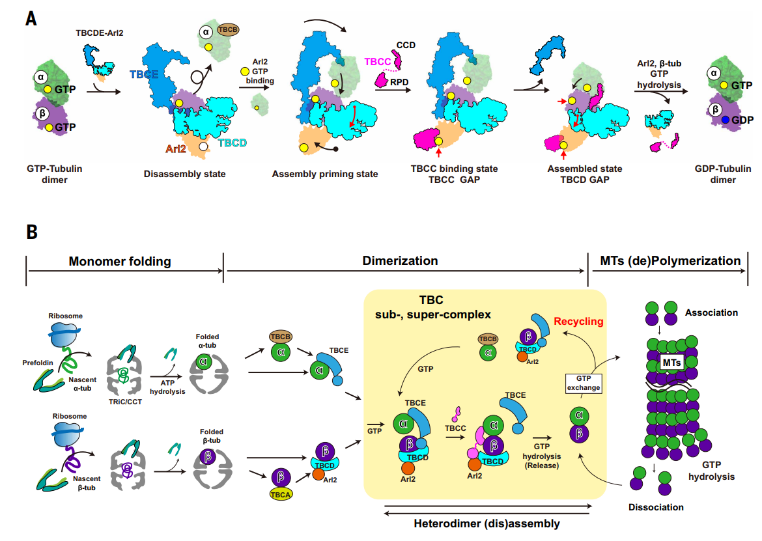
图6. TBCs在微管蛋白折叠、组装、回收和质量控制中的作用
这项工作修正了此前对 TBCs 功能的单一认知,将其角色从传统的组装辅助因子提升为微管蛋白稳态的核心调控者,为理解微管蛋白质量控制、细胞骨架稳态维持 及相关疾病(如神经退行性疾病、癌症)提供了结构基础。
青云瑞晶在该系列蛋白的表达以及与抑制剂的共晶结构解析方面累积了丰富的实验经验,已记录实验条件100+。基于这些实验条件和库存蛋白,可以将项目的交付时间缩短至1-2个月,并确保项目的成功交付。
青云瑞晶已完成T2R-TTL复合物(包括2 α-tubulin,2 β-tubulin,RB3和TTL)相关蛋白的表达纯化,复合物组装和复合物结构解析工作。成功重复出T2R-TTL复合物和Plinabulin晶体,并解析了该复合物结构(PDB ID:5C8Y)。