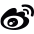01 成果简介
2025年7月1日,英国剑桥分子生物学实验室Ingo H. Greger等研究人在 Nature 上发表了题为“Architecture, dynamics and biogenesis of GluA3 AMPA glutamate receptors” 的文章。

该研究利用冷冻电镜解析了GluA3 同源受体的高分辨率结构,该结构与其他 AMPARs 存在显著差异。GluA3的胞外结构域(NTD和LBD)在不同门控状态下紧密耦合,形成了以前未见的界面,这些界面影响信号传递,并包含人类疾病突变位点。
进一步实验证实GluA3的NTD二聚体界面是调控受体运输、突触传递及疾病易感性的关键位点,这为开发针对GluA3相关疾病的靶向药物提供了结构基础和理论依据。
02 研究背景
AMPA型谷氨酸受体(AMPARs)是是大脑中主要的兴奋性神经传递介质,其功能异常与多种神经系统疾病相关。GluA3亚型因与癫痫、精神分裂症等神经发育疾病密切相关而备受关注,但其结构特征及致病机制长期不明确。GluA3在不同突触中分别作为钙通透性和钙非通透性受体发挥作用,这种双重功能与其独特的分子结构密切相关,有必要通过高分辨率结构解析揭示其调控机制。
03 图文概览
GluA3 的结构基础与界面特征
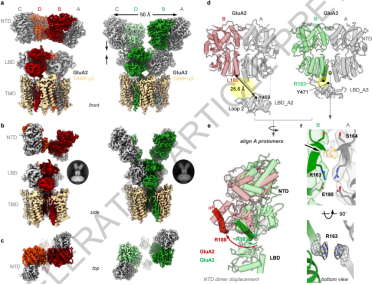
图1. GluA3-TARP-γ2复合物的结构
冷冻电镜结构显示,GluA3的NTD层与LBD层之间的紧密耦合,形成前所未有的NTD-LBD界面,这一结构特征与GluA2的松散NTD层形成鲜明对比。
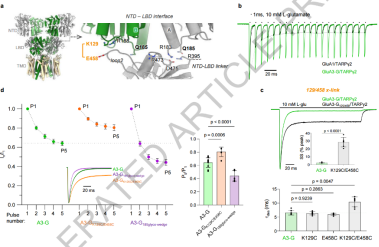
图2. GluA3的NTD-LBD界面功能验证
通过电生理实验和突变分析,证明该界面调控 GluA3 的受体动力学和突触信号传递。
GluA3 的构象动态与生物学功能
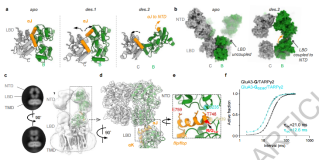
图3. 脱敏态 GluA3 的独特构象
脱敏态GluA3表现出独特构象,这种构象的稳定性对于其在突触传递中的高效性至关重要。
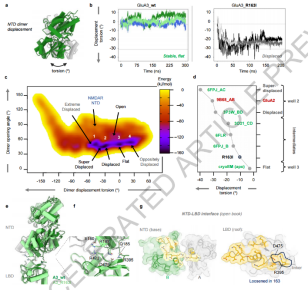
图4. GluA3 NTD的动力学
分子动力学模拟揭示了GluA3 NTD二聚体的动态变化及其对功能的影响,证实Arg163是维持GluA3结构稳定性和功能的关键残基。
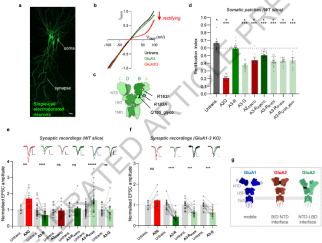
图5. GluA3 在神经元中的表面运输与突触传递
通过神经元电生理实验,证明NTD二聚体界面是调控受体生物合成与突触功能的核心机制。
04 结果讨论
该研究研究通过冷冻电镜解析了GluA3同源受体在静息、激活和脱敏状态下的三维结构,发现GluA3 具有独特的结构特征,其NTD和LBD的紧密耦合、Arg163 的堆叠相互作用等,是决定该受体信号传递功能及生物合成、运输过程的关键特征。
这些发现为理解 GluA3 的功能机制以及相关疾病的研究提供了重要框架,也为开发针对 GluA3 的药物提供了潜在靶点。