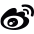01 成果简介
2025年5月5日,阿斯利康J. Henry Blackwell等人在JMC期刊上发表了题为“A Perspective on the Strategic Application of Deconstruction−Reconstruction in Drug Discovery”的论文。

本文概述了基于片段的解构-重构(FBDR)研究,并评估了其在药物发现中的应用价值。FBDR策略通过将已知的蛋白质配体分解为更小的片段,然后从这些片段重新构建,能够帮助研究人员更好地理解蛋白质的配体结合能力,并揭示在传统优化过程中可能被忽视的设计机会。本文通过分析一些案例研究,展示了FBDR在药物发现中的应用价值。
值得一提的是FBDR 研究中,结构生物学手段(如X射线晶体学、冷冻电镜等)扮演了至关重要的角色。这些技术为理解配体与蛋白质之间的相互作用提供了详细的结构信息,从而指导解构和重构过程。
02 背景介绍
研究人员经常使用将配体分解为片段大小的组件,然后从这些更简单的起点开始优化的策略,这种策略被称为基于片段的解构-重构(FBDR)。FBDR通常涉及将天然底物、蛋白质的辅因子或从传统筛选中获得的配体进行解构,然后再进行重建工作,以提供改进的蛋白质配体。FBDR研究可以显著影响药物发现项目,例如揭示蛋白质的结合热点、提供最小药效基团信息、针对特定缺陷进行优化,甚至可能意外发现新的结合模式。
03 图文概览
天然配体的解构研究
Stout等人通过X射线晶体学研究了脱氧尿苷单磷酸(dUMP)及其片段与大肠杆菌胸苷酸合成酶(TS)的结合。研究发现,某些dUMP片段(如dURD和ddURD)能够重现底物的相互作用网络和结合姿态,而其他片段则不能。这表明,即使在缺乏完整结构信息的情况下,通过解构也能揭示配体与蛋白质结合的关键特征。
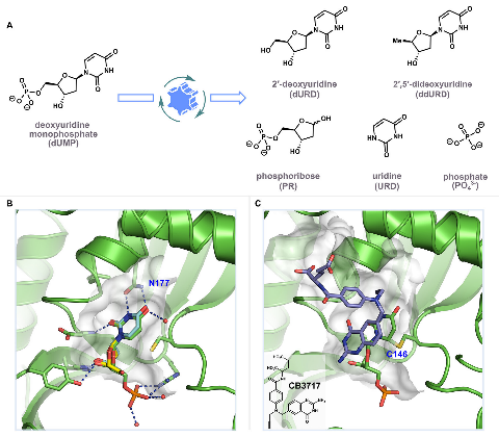
图1. dUMP及其片段与大肠杆菌胸苷酸合成酶(TS)的晶体结构
解构中存在的问题
并非所有片段都能重现其在完整配体中的结合姿态。Babaoglu和Shoichet对AmpC β-内酰胺酶抑制剂的解构研究表明,某些片段的结合姿态与预期完全不同,甚至导致酶的构象发生显著变化。这表明,解构过程中需要谨慎对待片段的结合模式,因为它们可能与原始配体的结合模式不同。
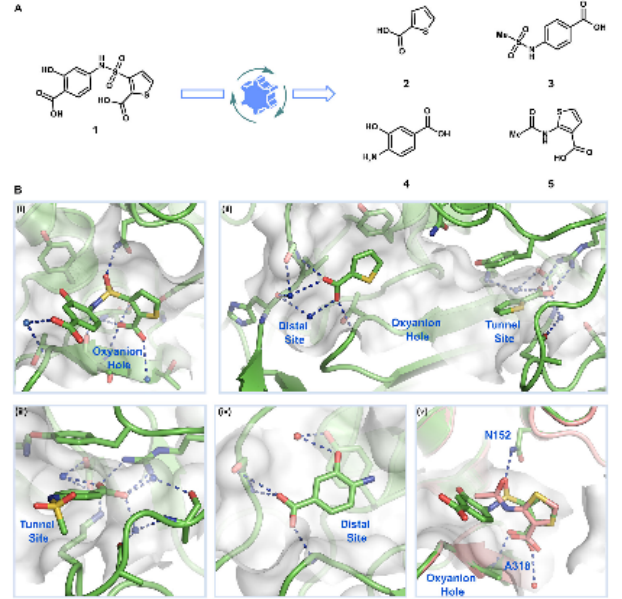
图3. AmpC β-内酰胺酶抑制剂的解构研究
最小药效基团的确定
FBDR的一个关键目标是识别能够重现配体与蛋白质相互作用的最小药效基团。例如,Novartis的研究人员通过解构PRC2抑制剂,识别出更高效、更易于合成的片段,这些片段保留了与蛋白质的关键相互作用。此外,解构还可以帮助评估蛋白质的可配体性,例如在PRMT和VHL的研究中,通过解构已知抑制剂,研究人员能够更好地理解这些蛋白质的结合位点,并为未来的片段筛选提供指导。
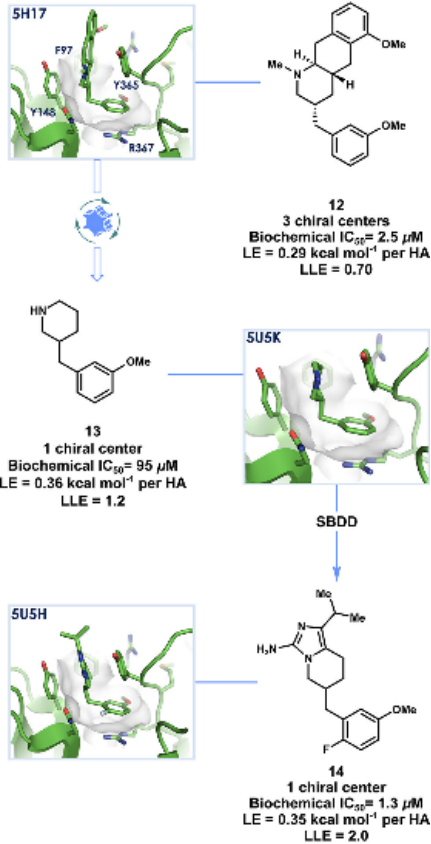
图6. PRC2抑制剂的解构与重构
通过重构改进先导化合物
解构后,研究人员可以通过片段生长或合并来构建新的配体。例如,Bach等人通过解构KEAP1-NRF2蛋白-蛋白相互作用抑制剂,识别出关键片段,并通过片段合并构建了具有更高结合亲和力的新型抑制剂。另一个例子是GSK的研究人员通过对PI3Kδ抑制剂的解构,识别出关键的吡啶磺酰胺核心,并通过系统的结构-活性关系(SAR)研究,开发出具有更高选择性和效力的新型抑制剂。
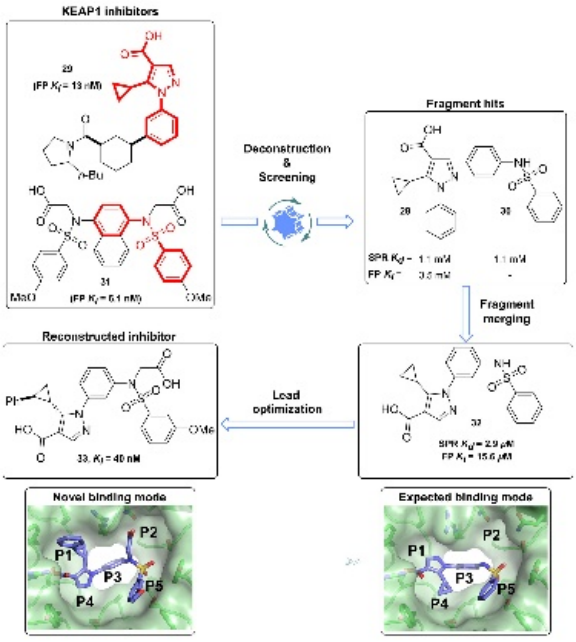
图10. KEAP1抑制剂的解构与重构
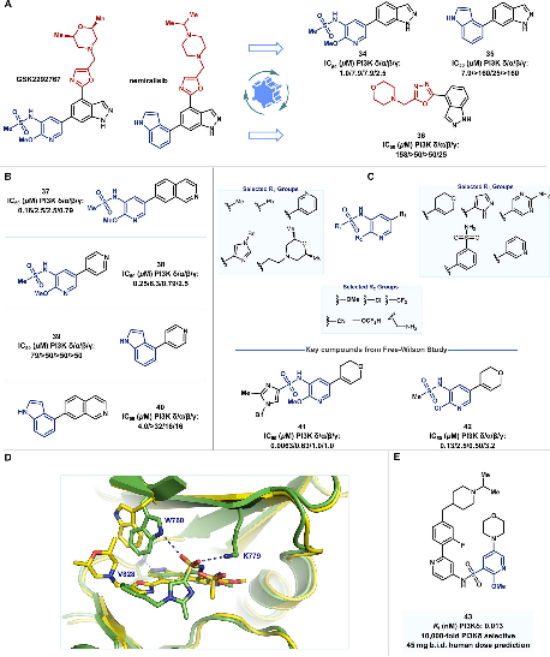
图11. PI3Kδ抑制剂的解构与重构
04 结果讨论
FBDR策略在药物发现中具有重要的应用价值。通过解构和重构,研究人员可以更好地理解蛋白质的配体结合能力,发现新的设计机会,并提供更高效的起点。虽然FBDR存在局限性,但通过谨慎应用和利用意外结果,可以为药物发现带来新的机遇。FBDR策略不仅适用于优化停滞的项目,还可以用于探索复杂靶点的结合模式,为药物发现提供新的思路和方法。
文献最后指出,FBDR策略的未来发展需要结合更多的计算方法和实验技术,以进一步提高其效率和成功率。例如,虚拟FBDR可以通过计算机辅助设计生成新的配体,而结构生物学手段则可以用于验证和优化这些设计。
结构生物学手段的作用
结构生物学手段(如X射线晶体学、冷冻电镜、NMR等)在FBDR研究中发挥了关键作用:
提供详细的结构信息:通过解析配体与蛋白质复合物的结构,研究人员可以明确配体的结合姿势和相互作用网络。
指导解构过程:帮助识别关键的结合热点和最小药效团,确保解构后的片段仍然能够与蛋白质有效结合。
评估片段的结合能力:通过解析片段与蛋白质复合物的结构,研究人员可以确认片段的结合姿势,并评估其结合亲和力。
指导重构过程:通过结构信息,研究人员可以设计和优化新的配体,提高其结合亲和力和选择性。